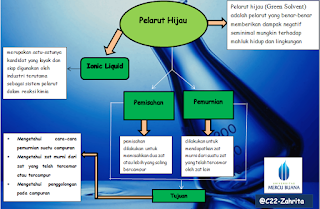
Pelarut Hijau
Pelarut hijau atau istilah asingnya “Green Solvent”. Sesungguhnya
bukanlah pelarut yang berwarna hijau tapi hanya sebuah istilah yang kini sedang
populer dibidang teknologi ramah lingkungan. Pelarut hijau adalah pelarut yang
benar-benar memberikan dampak negatif seminimal mungkin terhadap mahluk hidup
dan lingkungan. Tentu saja pelarut yang paling memenuhi syarat tersebut adalah
air sebagai pelarut universal. Sayangnya sifat kimia dari air membatasi
penggunaannya sebagai pelarut dalam proses produksi. Sedangkan teknologi yang
berkembang seiring dengan isyu “green chemistry” adalah ionic liquids, fluida
superkritis dan yang paling mutakhir adalah sistem pelarut dua fasa menggunakan
turunan senyawa fluor. Walau demikian, kedua sistem yang disebutkan terakhir masih
menemukan kendala dalam pemanfaatannya secara massal disebabkan masalah teknis
sehingga ionic liquids merupakan satu-satunya kandidat yang layak dan siap
digunakan oleh industri terutama sebagai sistem pelarut dalam reaksi kimia.
Sekilas tentang Ionic Liquid
Apa itu ionic liquid? Sebelum membahas lebih
lanjut, kita harus membedakan antara liquid (cairan/lelehan/leburan) dengan
solution (larutan). Larutan itu berasal dari padatan yang dilarutkan dalam
pelarut tertentu atau dari gas yang dikompres sehingga menjadi larutan.
Cairan/lelehan/leburan merupakan padatan garam yang dipanaskan sehingga
meleleh. Berangkat dari definisi ini, maka perbedaan antara larutan dengan
lelehan terletak dengan ada atau tidaknya pelarut. Larutan mengandung pelarut
dan lelehan tidak mengandung pelarut.
Garam-garam ionik anorganik biasanya memiliki titik leleh yang tinggi, di atas 1000 C. Kebalikan dari garam-garam anorganik, ionic liquid merupakan garam ionik/senyawa ionik yang memiliki titik leleh di bawah 100 C atau biasanya meleleh pada suhu ruangan. Biasanya ionic liquid merupakan garam-garam dari senyawa organik. Beberapa di antaranya dapat dilihat pada gambar.
Garam-garam ionik anorganik biasanya memiliki titik leleh yang tinggi, di atas 1000 C. Kebalikan dari garam-garam anorganik, ionic liquid merupakan garam ionik/senyawa ionik yang memiliki titik leleh di bawah 100 C atau biasanya meleleh pada suhu ruangan. Biasanya ionic liquid merupakan garam-garam dari senyawa organik. Beberapa di antaranya dapat dilihat pada gambar.
Beberapa sifat fisik dari ionic liquid
ditampilkan pada tabel berikut
Anggaplah sebuah garam KCl, kita tahu garam KCl dibentuk dari transfer elektron
antar masing-masing elemen, sementara di garam organik dapat dianggap sebagai
transfer proton antara asam-basa. Kation organik seperti emim+ dan bupy+
dihasilkan dari alkilasi basa Hmim+ dan py+. Anion seperti NO3- dihasilkan dari
reaksi asam basa Lewis. Lalu apakah perbedaannya dengan kimiawi proton di air?
Pertama proton asam di ionic liquid sering terjadi sebagai anion seperti HCl2-,
HBr2-, H2Br3- daripada kation. Kedua, proton yang diikat oleh basa seperti
1-metilimidazole dan piridin tidak bersifat labil. Basa di ionic liquid tidak
selalu sebanding dengan pKb di air melainkan dengan afinitas proton fasa
gasnya.
Apa yang
terjadi ketika air ditambahkan ke ionic liquid atau tidak dihilangkan secara
total ketika tahap preparasi? Pertama, beberapa anion seperti AlCl4- dan HCl2-
akan terdekomposisi secara irreversibel. Kedua, Air mungkin berinteraksi dengan
kuat dengan salah satu ion. Ketiga, air mungkin akan melarutkan garam hingga
membentuk larutan garam jenuhnya. Keempat, pda temperatur tinggi mungkin akan
mendekomposisi beberapa spesies anionik.Lalu apa sih manfaat dari ionic liquid? Jawabannya sangat banyak antara lain sebagai high energetic material, solvent dll. Oia, mungkin ada yang bertanya bagaimana mungkin garam memiliki titik leleh yang sedemikian rendahnya? Jawabannya terletak pada struktur garamnya. Perhatikan gambar di bawah ini.
Jika kita lihat, struktur garam NaCl sangat kompak, sehingga menghasilkan interaksi yang sangat kuat antara kation-anion sehingga dibutuhkan energi tinggi untuk melelehkannya atau dengan kata lain butuh suhu tinggi untuk melelehkannya, sementara di ionic liquid struktur antar masing-masing garam tidak kompak, sehingga interaksi antar kation-anion lemah ataudengan kata lain diperlukan energi yang rendah untuk melelehkannya.
Pemisahan dan Pemurnian
Pemisahan dan pemurnian merupakan suatu cara yang dilakukan untuk memisahkan atau memurnikan suatu senyawa atau sekelompok senyawa yang mempunyai susunan kimia yang berkaitan dari suatu bahan, baik dalam skala laboratorium maupun skala industri. Pada prinsipnya, pemisahan dilakukan untuk memisahkan dua zat atau lebih yang saling bercampur, sedangkan pemurnian dilakukan untuk mendapatkan zat murni dari suatu zat yang telah tercemar oleh zat lain.
Pemisahan dan pemurnian campuran memiliki manfaat yang sangat penting dalam ilmu kimia, industri maupun dalam kehidupan sehari-hari, dalam banyak kasus kita dapat menggunakan material tanpa pemurnian, baik material itu dari alam (misalnya minyak tanah) atau yang disintesis di laboratorium, Pemisahan atau pemurnian dengan metode tertentu perlu dilakukan. Demikian pula dalam pekerjaan di laboratorim maupun dalam proes industi banyak yang melibatkan pemisahan dan pemurnian. Misalnya pengolahan bijih dari pertambangan, pemisahan logam dari mineralnya, pengolahan minyak bumi, pengolahan air minum dan lain-lain. Sedangkan contoh sederhana pemisahan dan pemurnian yang sering dilakukan dalam kehidupan sehari-hari misalnya pemisahan ampas kelapa dengan santannya yang dilakukan dengan metode penyaringan.
Dalam melakukan pemisahan dan pemurnian diperlukan pengetahuan dan keterampilan, terutama jika harus memisahkan komponen dengan kadar yang sangat kecil. Untuk tujuan itu, dalam ilmu kimia telah dikembangkan berbagai cara pemisahan dari pemisahan sederhana yang sering dilakukan sehari-hari sampai metode pemisahan dan pemurnian yang kompleks atau tidak sederhana.
Zat atau materi dapat dipisah dari campurannya karena campuran tersebut memiliki perbedaan sifat, itulah yang mendasari pemisahan campuran atau dasar pemisahan.
Dalam kenyataannya pemisahan dan pemurnian tidak dapat dipisah satu sama lain. Kita akan melihat bahwa ketika metode pemisahan dan pemurnian baru dikembangkan, ilmu kimia akan mendapatkan kemajuan yang besar.
Percobaan pemisahan dan pemurnian ini dilakukan agar kita dapat mengetahui jeni-jenis pemisahan dan pemurnian pada campuran dan bagaimana aplikasinya dalam kehidupan sehari-hari.
Tujuan
-
Mengetahui cara-cara pemurnian suatu campuran
-
Mengetahui zat murni dari zat yang telah tercemar atau tercampur
-
Mengetahui penggolongan pada campuran
Daftar Pustaka
http://ceengineermu.weebly.com/pemisahan-dan-pemurnian.html




Tidak ada komentar:
Posting Komentar
Catatan: Hanya anggota dari blog ini yang dapat mengirim komentar.