STRUKTUR MOLEKUL
Struktur molekul adalah penggambaran
ikatan-ikatan unsur atau atom yang membentuk molekul. Molekul terdiri dari
sejumlah atom yang bergabung melalui ikatan kimia, baik itu ikatan kovalen,
ikatan hidrogen dan ikatan ion, serta ikatan-iktan kimia lainnya.
- BENTUK MOLEKUL
- Bentuk Molekul Berdasarkan Teori VSEPR
Teori VSEPR adalah teori yang menggambarkan bentuk molekul berdasarkan kepada tolakan pasangan electron disekitar atom pusat. Teori talakan pasangan electron ini dikenal dengan istilah VSEPR (Valence Shell Electron Pair of Repulsion)
Bentuk molekul didasarkan kepada jumlah electron yang saling tolak-menolak disekitar atom pusat yang akan menempati tempat sejauh munkin untuk meminimumkan tolakan.
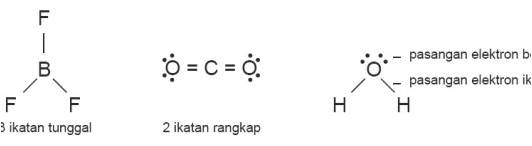

- Symbol – symbol dalam teori VSEPR
- A : Atom pusat
- X : Jumlah pasangan electron ikatan
- E : jumlah Pasangan electron bebas
Rumusan tipe molekul dapat ditulis dengan lambang AXnEm (jumlah pasangan electron)
Catatan: ikatan rangkap dua atau rangkap tiga dihitung satu pasang electron ikatan
Cara meramalkan bentuk molekul dengan teori VSEPR
- Tentukan struktur lewis dari rumus moleku
- Tentukan jumlah PEB dan PEI atom pusat
- Prediksi besar sudut ikatan dan arah yang munkin akibat tolakan
- Gambar bentuk molekul dan beri nama sesuai dengan jumlah PEI dan PEB
Catatan 2 : tolakan antara PEB-PEB> PEB-PEI>PEI-PEI
Lebih lengkapnya dapat dilihat pada tabel berikut ini:

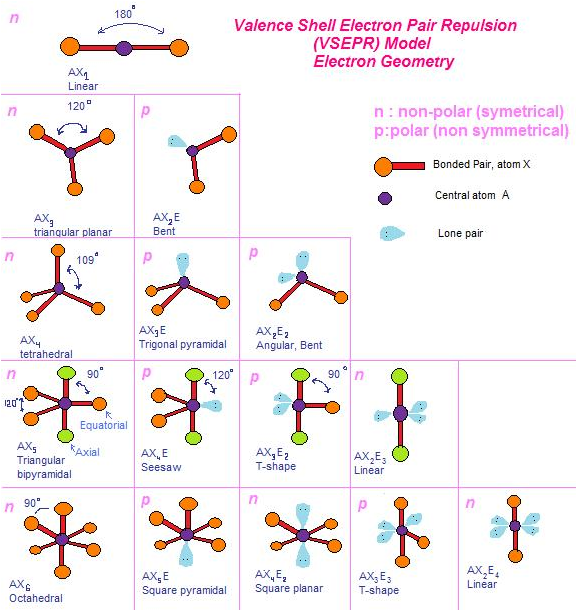
Terdapat sekitar tujuh bentuk molekul yang sederhana, yaitu bentuk
linear, trigonal planar, trigonal piramidal, segiempat datar, tetrahedral,
tirogonal bipiramidal, dan oktahedral.
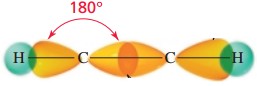
1. Bentuk Linear
Suatu molekul dikatakan linear jika atom-atom yang menyusun
molekul tersebut berada dalam suatu garis lurus. Contohnya, BeCl2
dan CO2. Sudut yang dibentuk oleh
ikatan antara dua atom melalui atom
pusat sebesar 180°.
2. Trigonal Planar
Suatu bentuk molekul dikatakan trigonal planar jika di dalam
molekulnya terdapat empat buah atom dan semua atom berada pada
bidang yang sama. Atom pusat dikelilingi oleh tiga atom lain yang berada
pada sudut-sudut segitiga. Sudut ikatan yang dibentuk di antara dua
ikatan melalui atom pusat sama besar yaitu 120°. Contohnya, molekul
BCl3 dan BF3.
3. Trigonal Piramidal
Trigonal piramidal adalah suatu bentuk molekul dengan empat buah
muka segitiga sama sisi. Suatu molekul dikatakan berbentuk trigonal
piramidal jika memilki empat buah atom. Atom pusat ditempatkan pada
sudut puncak limas, dan atom lainnya berada pada sudut-sudut limas
yang berada pada bidang datar segitiga. Contohnya, molekul NH3.
4. Bujur Sangkar
Suatu bentuk molekul dikatakan bujur sangkar jika dalam molekul
terdapat lima buah atom dan semua atom berada pada bidang datar yang
sama. Atom pusat dikelilingi oleh empat atom lain yang berada pada sudut-
sudut segiempat. Sudut ikatan yang dibentuk antara dua ikatan yang
melalui pusat sama besar, yaitu 90°. Contohnya, molekul XeF4.
5. Tetrahedral
Tetrahedral adalah limas segiempat dengan muka segitiga sama sisi.
Suatu bentuk molekul tergolong tetrahedral jika dalam molekulnya
terdapat lima buah atom. Atom pusat ditempatkan pada pusat tetrahedral
dan empat atom lain berada pada sudut-sudut tetrahedral yang terlihat
pada ujung-ujung bidang segitiga sama sisi. Sudut ikatan yang dibentuk
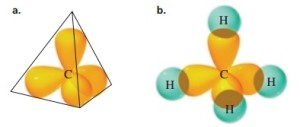
sama besar, yaitu 109,5°. Contohnya, molekul CH4.
6. Trigonal Bipiramidal
Trigonal bipiramidal terdiri atas dua buah limas yang bagian alasnya
berimpit. Suatu molekul memiliki bentuk trigonal bipiramidal jika dalam
molekulnya terdapat enam buah atom.
Dalam trigonal bipiramidal, atom pusat ditempatkan pada pusat alas
yang berimpit dan dikelilingi oleh lima atom lain yang ditempatkan pada
sudut-sudut trigonal bipiramidal. Dalam bentuk molekul ini sudut ikatan
tidak sama. Sudut ikatan yang terletak pada pusat bidang datar segitiga
masing-masing 120°, sedangkan sudut ikatan antara bidang pusat dan titik
sudut atas serta bawah bidang adalah 90°. Contohnya, molekul PCl5.
7. Oktahedral
Oktahedral adalah bentuk yang memiliki delapan muka segitiga,
dibentuk dari dua buah limas alas segiempat yang berimpit. Suatu molekul
memiliki bentuk oktahedral jika tersusun dari tujuh atom.
Atom pusat ditempatkan pada pusat bidang segiempat yang berimpit.
Enam atom lain terletak pada sudut-sudut oktahedral. Sudut antarikatan
yang terbentuk sama besar, yaitu 90°. Contohnya, molekul SF6 dan XeF6
2.Bentuk Molekul menurut Teory Hibridisasi
yaitu bentuk molekul yang didasarkan kepada bentuk orbital kulit terluarnya, dimana terjadi pengabungan beberapa orbital membentuk orbital yang baru yang tingkat energinya sama yan disebut dengan hibridisasi.
Pembentukan orbital hibrida dapat dilihat dari contoh berikut:
molekul PCl5

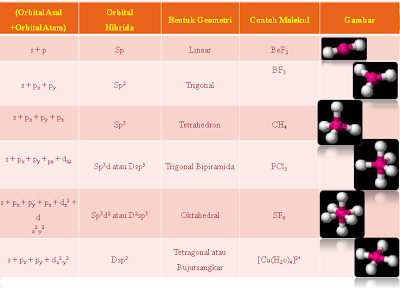
sp
sp2
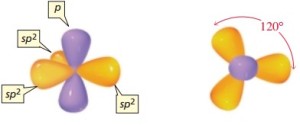
sp3
GAYA ANTAR MOLEKUL
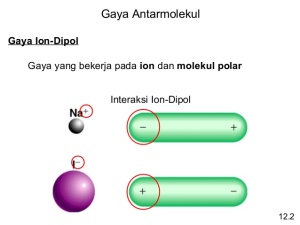
Gaya antarmolekul adalah gaya aksi di antara molekul-molekul yang menimbulkan tarikan antarmolekul dengan berbagai tingkat kekuatan. Pada suhu tertentu, kekuatan tarikan antarmolekul menentukan wujud zat, yaitu gas, cair, atau padat. Kekuatan gaya antarmolekul lebih lemah dibandingkan ikatan kovalen maupun ikatan ion. Ikatan kimia dan gaya antarmolekul memiliki perbedaan. Ikatan kimia merupakan gaya tarik menarik di antara atom- atom yang berikatan, sedangkan gaya antarmolekul merupakan gaya tarik menarik di antara molekul (perhatikan Gambar 2.23).
Ada tiga jenis gaya antarmolekul, yaitu gaya dipol-dipol, gaya London, dan ikatan hidrogen. Gaya dipol-dipol dan gaya London dapat dianggap sebagai satu jenis gaya, yaitu gaya van der Waals.
- Gaya Dipol-Dipol
Gaya dipol-dipol adalah gaya yang terjadi di antara molekul-molekul yang memiliki sebaran muatan tidak homogen, yakni molekul-molekul dipol atau molekul polar. Molekul-molekul polar memiliki dua kutub muatan yang berlawanan. Oleh karena itu, di antara molekul-molekulnya akan terjadi antaraksi yang disebabkan kedua kutub muatan yang dimilikinya. Pada antaraksi dipol-dipol, ujung-ujung parsial positif suatu molekul mengadakan tarikan dengan ujung-ujung parsial negatif dari molekul lain yang mengakibatkan orientasi molekul-molekul sejajar. Tarikan dipol-dipol memengaruhi sifat-sifat fisik senyawa, seperti titik leleh, kalor peleburan, titik didih, kalor penguapan, dan sifat fisik lainnya.
Semakin kuat gaya antaraksi antarmolekul, semakin besar energi yang diperlukan untuk memutuskannya. Dengan kata lain, semakin tinggi titik didihnya. Hal ini menunjukkan bahwa dalam molekul polar terjadi gaya antaraksi yang relatif lebih kuat dibandingkan dalam molekul nonpolar.
- Gaya London
Gaya London adalah gaya yang terjadi pada atom atau molekul, baik polar maupun nonpolar. Gaya London atau disebut juga gaya dispersi, yaitu gaya yang timbul akibat dari pergeseran sementara (dipol sementara) muatan elektron dalam molekul homogen. Dalam ungkapan lain, dapat dikatakan bahwa gaya London terjadi akibat kebolehpolaran atau distorsi “awan elektron” dari suatu molekul membentuk dipol sementara (molekul polar bersifat dipol permanen). Mengapa awan elektron dapat terdistorsi? Hal ini dapat dijelaskan sebagai berikut.
- Pada sekumpulan besar molekul, setiap saat selalu terjadi tumbukan antarmolekul, tumbukan ini menimbulkan dipol sementara membentuk muatan parsial positif pada salah satu ujung molekul dan muatan parsial negatif pada ujung yang lain (terdistorsi).
- Molekul-molekul yang terdistorsi selanjutnya menginduksi molekul lain membentuk dipol terinduksi.
- Akibat terbentuk dipol sementara pada sejumlah molekul yang bertumbukan dan menginduksi sejumlah molekul lain membentuk dipol terinduksi, menimbulkan gaya tarik-menarik di antara molekul- molekul tersebut. Gaya tarik-menarik seperti ini dinamakan gaya London.
- Gejala tersebut berlangsung secara terus menerus dan berimbas kepada molekul-molekul lain sehingga terjadi gaya London di antara molekul-molekul yang ada. Dengan demikian, gaya London adalah gaya antaraksi antaratom atau molekul yang memiliki dipol sementara dengan jarak yang sangat berdekatan satu sama lain. Kekuatan gaya London dipengaruhi oleh ukuran, bentuk molekul, dan kemudahan distorsi dari awan elektron. Sentuhan di antara atom atau molekul dengan luas permukaan sentuhan besar menghasilkan peluang lebih besar membentuk dipol sementara dibandingkan bidang sentuh yang relatif kecil. Semakin besar luas permukaan bidang sentuh molekul, semakin besar peluang terjadinya dipol sementara.
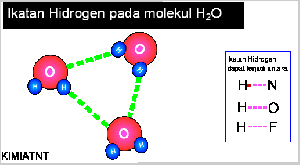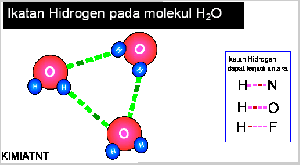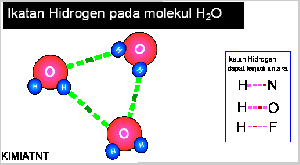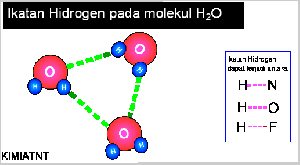
- Ikatan Hidrogen
Senyawa yang mengandung atom hidrogen dan atom yang memiliki keelektronegatifan tinggi, seperti fluorin, klorin, nitrogen, dan oksigen dapat membentuk senyawa polar, Akibatnya, atom hidrogen menjadi lebih bermuatan positif. Akibat dari gejala tersebut, atom hidrogen dalam molekul polar seolah-olah berada di antara atom-atom elektronegatif. Apa yang akan terjadi jika atom hidrogen yang bermuatan parsial positif berantaraksi dengan atom-atom pada molekul lain yang memiliki muatan parsial negatif dan memiliki pasangan elektron bebas. Anda pasti menduga akan terjadi antaraksi di antara molekul-molekul tersebut sebab molekulnya polar. Berdasarkan hasil pengamatan, dalam senyawa-senyawa polar yang mengandung atomhidrogen ada antaraksi yang lebih kuat dibandingkan antaraksi dipol maupun gaya London. Antaraksi ini dinamakan ikatan hydrogen.
IKATAN VALENSI
Dalam bentuk molekul dikenal adanya
teori ikatan valensi. Teori ini menyatakan bahwa ikatan antar atom terjadi
dengan cara saling bertindihan dari orbital-orbital atom. Elektron dalam
orbital yang tumpang tindih harus mempunyai bilangan kuantum spin yang berlawanan.
Pertindihan antara dua sub kulit s tidak kuat, oleh karena distribusi muatan
yang berbentuk bola, oleh sebab itu pada umumnya ikatan s – s relatif lemah.
Sub kulit “p” dapat bertindih dengan sub
kulit “s” atau sub kulit “p” lainnya, ikatannya relatif lebih kuat, hal ini
dikarenakan sub kulit “p” terkonsentrasi pada arah tertentu.
FAKTOR – FAKTOR YANG MEMPENGARUHI
BENTUK MOLEKUL
Berdasarkan teori domain elektron:
1. Setiap pasangan elektron pada kulit terluar, baik pasangan elektron ikatan
maupun pasangan elektron bebas menempati ruang tertentu, yang disebut domain.
2. Ikatan rangkap menempati satu domain, karena pasanngan elektron pada ikatan
rangkap berada pada daerah atau ruang yang sama diantara dua atom yang
berikatan.
3. Pasangan elektron bebas dan pasanga elektron ikatan rangkap menempati ruang
lebih besar dibandingkan ruang yang ditempati pasangan elektron ikatan tunggal.
4. Setiap pasangan elektron saling tolak – menolak satu sama lain dengan
urutan kekuatan tolakan: PEB-PEB > PEI-PEB > PEI-PEI (PEB = pasangan
elektron bebas, PEI = pasangan elektron ikatan)
5. Setiap domain pasangan elektron mengambil tempat sedemikian rupa sehingga
tolakan diantara pasangan elektron sekecil mungkin.
6. Bentuk molekul ditentukan oleh pasangan elektron ikatan.
Berdasarkan hibridisasi :
1. Hanya orbital-orbital yang memiliki tingkat energy berdekatan yang dapat
bercampur menghasilkan orbital hibrid yangn baik.
2. Jumlah orbital hibrid yang dihasilkan sama dengan banyaknya orbital
yang bercampur.
3. Orbital hibrid diberi lambing sesuai dengan jenis dan jumlah orbital yang
bercampur.
4. Orbital hibrid memiliki tingkat energi diantara tingkat energy
orbital-orbital atom yang bercampur. Urutan tingkat energi orbital hibrid:
sp < sp2 < sp3 < dsp2 <
d2sp3.
5. Dalam hibridisasi yang bercampur adalah sejumlah orbital bukan sejumlah
elektron.
6. Orbital – orbital hibrid memiliki orientasi ruang yang menentukan struktur
molekul.
DAFTAR PUSTAKA

Tidak ada komentar:
Posting Komentar
Catatan: Hanya anggota dari blog ini yang dapat mengirim komentar.