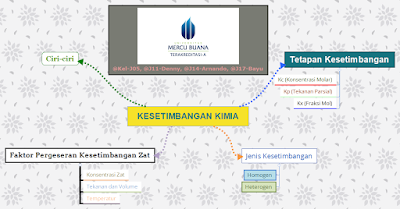
 |
| (Gambar 1: Mind Maping) |
Oleh: Denny Farazumar Arief Kelana, Arnando, Muhammad Bayu Adji (@Kel-J05, @J11-Denny, @J14-Arnando, @J17-Bayu).
ABSTRAK: Kalian sudah pada tahu belum sih apa itu
kesetimbangan? Untuk yang suka pelajaran kimia pasti tidak asing dengan kata
ini. Bagi yang tidak bagaimana? Setelah kalian tahu apa itu, bagaimana
kesetimbangan kimia pasti kalian langsung suka. Jadi langsung aja deh kita
jelasin tentang kesetimbangan kimia.
Apa Itu Kesetimbangan Kimia?
Kesetimbangan berasal dari kata setimbang. Dalam bahasa Indonesia setimbang dapat diartikan sebagai suatu kedaan dimana dua benda memiliki berat dan kedudukan serta berada dalam posisi yang sama. Sedangkan berdasarkan ilmu kimia kimia setimbang merupakan dua proses memiliki keadaan yang berlawanan arah. Proses tersebut berlangsung secara terus menerus dan bersifat simultan. Berdasarkan pengertian diatas maka kesetimbangan kimia dapat diartikan sebagai suatu keadaan reaksi bolak-balik dengan kesamaan laju reaktan dan laju terbentuknya produk serta konsentrasinya tetap. Reaksi tersebut terjadi secara bolak balik (memiliki dua arah yang berbeda) dan berlangsung secara terus menerus.
Ciri- Ciri Kesetimbangan Kimia.
Ciri-ciri dari keadaaan setimbang adalah sebagai berikut:
- Reaksi terjadi dalam tempat atau wadah tertutup dengan suhu dan tekanan yang tetap.
- Merupakaan reaksi yang bersifat dinamis (terjadi secara terus menerus).
- Reaksi terjadi dalam dua arah yang berlawanan.
- Laju reaksi ke reaktannya sama dengan laju reaksi ke produknya.
- Produk dan reaktan memiliki konsentrasi yang sama.
- Merupakan reaksi yang terjadi secara mikroskopik (reaksi pada tingkat partikel zat).
Tetapan Kesetimbangan.
Hukum Kesetimbangan Kimia dikemukakan oleh Guldberg dan Waage pada tahun 1866. Hukum kesetimbangan kimia ini dikenal juga dengan istilah Hukum Aksi Massa. Dalam hukum tersebut dikemukakan bahwa pada suhu dan tekanan tertentu perbandingan hasil kali konsentrasi zat-zat disebelah kanan persamaan reaksi akan sama dengan dengan konsentrasi zat-zat sebelah kiri yang masing-masing dipangkatkan dengan koefesien reaksinya adalah tetap. Zat-zat di sebelah kanan adalah zat hasil reaksi sedangkan zat-zat di sebelah kiri adalah zat pereaksi. Contoh reaksi:
Untuk menentukan ukuran seberapa jauh suatu reaksi berlangsung (K), digunakan persamaan berikut:
Harga K menunjukkan banyaknya hasil reaksi yang terbentuk. Tetapan K ini akan membentuk tetapan kesetimbangan (K) sehingga terbentuk Kc,Kp dan Kx. Kc menyatakan kesetimbangan molar (larutan dan gas), Kp menyatakan kesetimbangan tekanan parsial (gas) dan Kx menyatakan kesetimbangan dalam frasi mol (larutan dan gas).
- Kc (konsentrasi molar).
Persamaan konsentrasi molar yaitu:
- Kp (tekanan Parsial).
Persamaan yang digunakan untuk menentukan tekanan parsial adalah: - Kx (fraksi mol).
Untuk menentukan fraksi mol suatu reaksi digunakaan persamaan berikut:
Kp dan Kc memiliki hubungan, hubungan Kp dan Kc tersebut ditentukan menggunakan persamaan berikut:
∆n merupakan hasil pengurangan antara jumlah mol gas hasil reaksi dengan jumlah mol gas reaktan.
Catatan:
Jika :
 |
| (Gambar 8: Perubahan Jumlah Mol Gas Hasil Reaksi. Sumber: https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEioH8D1iRByqASRQgLifb66TIXNbwQysAUBZjSK_UONjSwTIGNkMpkdiwN-9J7o_rkVDDSZB0HJWSYnfyMqB37mVA7VX7FLxdNrxFyQNqdoyxQ8xoLQiHUDLxK81av8kEcCAjNJdWVUmKZD/s1600/KC+5.jpg) |
Sedangkan hubungan antara Kp dan Kx dinyatakan dengan persamaan berikut ini:
Kp = Kx P∆n, Dengan P adalah tekanan total.
Faktor Pergeseran Kesetimbangan Zat.
Dalam reaksi kimia ternyata terjadi pergeseran kesetimbangan. Pergeseran kesetimbangan kimia ini terjadi karena pengaruh beberapa faktor. Faktor-faktor yang menyebabkan pergeseran kesetimbangan kimia adalah sebagai berikut:
1. Konsentrasi zat.
Pada reaksi kimia jika konsentrasi suatu zat ditambah atau dikurangi, akan menyebabkan pergeseran pada kesetimbangannya. Jika konsentrasinya ditambah, kesetimbangan akan bergerak menjauhi zat yang ditambahkan konsentrasinya. Begitu pula sebaliknya, jika konsentrasi zat dikurangi maka kesetimbangan akan bergerak mendekati zat yang dikurangi konsentrasinya.
2. Tekanan dan Volume.
Tekanan dan volume mempengaruhi kesetimbangan kimia. Secara sederhana dapat dijelaskan bahwa tekanan dan volume merupakan dua hal yang berbanding terbalik dalam kesetimbangan kimia. Namun keduanya dapat menyebabkan pergeseran kesetimbangan kimia. Pengaruh tekanaan dan volume terhadap kesetimbangan yaitu:
- Jika pada suatu sistem tekanan ditambahkan dan volumenya diperkecil, akan menyebabkan reaksi kesetimbangan mengalami pergeseran ke arah zat yang jumlah molekulnya lebih kecil, Pergeseran terjadi kearah kanan.
- Jika pada suatu sistem tekanan diperkecil dan volume diperbesar akan menyebabkan reaksi kesetimbangan bergeser ke arah yang jumlah molekulnya lebi besar, Pergeseran terjaadi kearah kiri.
3. Temperatur.
Temperatur akan menyebabkan pergeseran kesetimbangan. Temperatur ini berkaitan dengan kalor, sehingga arah pergeseran kesetimbangan kimia adalah pada zat yang menerima (membutuhkan) kalor dan zat yang melepaskan kalor. Jika temperatur dinaikkan pergesaran kesetimbangan kimia akan menuju ke arah reaksi yang membutuh kalor. Sebaliknya, jika temperatur diperkecil, pergeseraan kesetimbangan kimia akan menuju ke arah reaksi yang melepaskan kalor.
Jenis Kesetimbangan.
Terdapat dua jenis kesetimbangan, yaitu :
1. Kesetimbangan Homogen.
Reaksi Kesetimbangan Homogen merupakan reaksi kesetimbangan dimana semua fasa senyawa yang bereaksi sama. Contoh :
- N2(g) + 3H2(g) D 2NH3(g)
- H2O(aq) D H+(aq) + OH-(aq)
- CH3COOH(aq) D CH3COO-(aq) + H+(aq)
Reaksi Kesetimbangan Heterogen adalah reaksi kesetimbangan dimana fasa reaktan dan produk memiliki fasa yang berbeda. Contoh:
- CaCO3(s) D CaO(s) + CO3(g)
- Ag2CrO4(s) D Ag2+(aq) + CrO42-(aq)
- 2 C(s) + O2(g) D 2CO(g)
DAFTAR PUSTAKA
- (Anonim. 2018. Kesetimbangan Kimia. ilmudasar.com dalam: http://www.ilmudasar.com/2018/02/Kesetimbangan-Kimia-adalah.html diakses tanggal 15 Oktober 2018).
- (Anwar, Khaerul. 2017. Kesetimbangan Kimia. keseimbangankimia15a.blogspot.com dalam: http://keseimbangankimia15a.blogspot.com/2017/06/keseimbangan-kimia.html diakses tanggal 15 Oktober 2018).
- (Atkins, P.W. 1999. Kimia Fisik Jilid I. Terjemahan Irma I.Kartohadiprojo. Jakarta: Erlangga).
- (Putri, Illona. Kesetimbangan Kimia. illonaputri.wordpress.com dalam: https://illonaputri.wordpress.com/kimia-kelas-xi/semester-1/kesetimbangan-kimia/ diakses tanggal 15 Oktober 2018).
- (Sukardjo. 1997. Kimia Fisika. Jakarta: PT Rineka Cipta).








@J18-ivan @J20-Fadilah @kel-J06
BalasHapusReaksi kimia ada yang berlangsung searah (berkesudahan) dan ada yang dapat balik (bolak-balik). Jelaskan perbedaanya disertai dengan contoh-contohnya.
@J11-Denny, @J14-Arnando, @J17-Bayu, @Kel-J05
Hapusreaksi yang berlangsung searah (berkesudahan) yaitu reaksi kimia di mana zat-zat hasil reaksi tidak dapat saling bereaksi kembali menjadi zat pereaksi contohnya :
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
Sedangkan reaksi dapat balik (bolak-balik) yaitu reaksi kimia di mana zat-zat hasil reaksi dapat saling bereaksi kembali menjadi zat pereaksi, contohnya:
PbSO4(s) + 2NaI(aq) ⇔ PbI2(s) + Na2SO4(aq)
Mantap :*