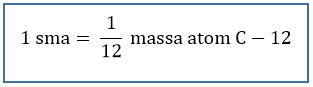ABSTRAK
Peluruhan radioaktif merupakan fenomena alamiah yang melibatkan perubahan spontan inti atom suatu unsur menjadi unsur lain dengan melepaskan energi berupa radiasi. Artikel ini menjelaskan secara mendalam mengenai peluruhan radioaktif, mencakup konsep dasar, jenis-jenis peluruhan, dan dampaknya terhadap lingkungan dan kesehatan manusia.
PENDAHULUAN
Peluruhan radioaktif telah menjadi fokus utama penelitian dalam fisika nuklir dan memiliki implikasi yang signifikan dalam berbagai bidang, mulai dari ilmu pengetahuan hingga teknologi. Dengan pemahaman yang lebih baik tentang proses ini, kita dapat mengoptimalkan penggunaannya dalam berbagai aplikasi, sambil tetap memahami risiko yang terkait.
PEMBAHASAN
Konsep dasar peluruhan radioaktif
melibatkan perubahan spontan inti atom suatu unsur menjadi unsur lain dengan memancarkan partikel atau radiasi. Ini terjadi karena inti atom yang tidak stabil berusaha mencapai kestabilan melalui transformasi. Beberapa poin kunci konsep dasar peluruhan radioaktif melibatkan:
1.Inti Radioaktif:
Inti atom yang tidak stabil disebut inti radioaktif. Inti ini cenderung mengalami peluruhan untuk mencapai kestabilan.
2.Isotop:
Isotop adalah atom dari suatu unsur yang memiliki jumlah proton yang sama tetapi jumlah neutron yang berbeda di dalam inti atomnya. Isotop satu dengan yang lain dapat memiliki sifat radioaktif yang berbeda.
3.Peluruhan dan Energi:
Selama peluruhan, inti atom melepaskan energi dalam bentuk partikel subatomik atau radiasi elektromagnetik. Ini dapat berupa partikel alfa, beta, atau foton gamma.
4.Waktu Paruh:
Waktu paruh adalah waktu yang diperlukan setengah dari suatu sampel inti radioaktif untuk mengalami peluruhan. Ini merupakan indikator kestabilan atau ketidakstabilan suatu unsur.
5.Hukum Peluruhan Radioaktif:
Hukum peluruhan radioaktif menyatakan bahwa tingkat peluruhan suatu inti radioaktif proporsional terhadap jumlah inti yang ada pada suatu waktu tertentu.
6.Peluruhan Alfa, Beta, dan Gamma:
Peluruhan alfa melibatkan emisi partikel alfa (inti helium). Peluruhan beta melibatkan transformasi neutron menjadi proton atau sebaliknya dengan pelepasan partikel beta. Peluruhan gamma melibatkan emisi foton gamma.
7.Perubahan Identitas Unsur:
Selama peluruhan, unsur asal berubah menjadi unsur baru dengan nomor atom yang berbeda. Ini dapat menghasilkan rantai peluruhan isotop yang berbeda hingga membentuk unsur yang stabil.
Jenis peluruhan radioaktif
utama melibatkan emisi partikel atau radiasi tertentu. Berikut adalah jenis-jenis peluruhan radioaktif yang umum: 1.Peluruhan Alfa (α): Dalam peluruhan alfa, inti atom melepaskan partikel alfa, yang terdiri dari dua proton dan dua neutron. Contoh: Peluruhan radium-226 menjadi radon-222.
2.Peluruhan Beta (β):
Peluruhan beta melibatkan transformasi neutron menjadi proton atau sebaliknya di dalam inti atom. Dalam peluruhan beta, sebuah neutron berubah menjadi proton dan dilepaskan sebagai partikel beta. Contoh: Peluruhan carbon-14 menjadi nitrogen-14.
3.Peluruhan Gamma (γ): Peluruhan gamma tidak melibatkan perubahan pada jumlah proton atau neutron dalam inti atom, tetapi melibatkan emisi foton gamma, yaitu radiasi elektromagnetik. Ini sering terjadi setelah peluruhan alfa atau beta. Contoh: Peluruhan uranium-238 menghasilkan radionuklida yang kemudian mengalami peluruhan gamma.
4.Peluruhan Delta (δ): Peluruhan delta atau peluruhan positron melibatkan transformasi proton menjadi neutron dengan melepaskan positron. Contoh: Peluruhan potassium-40 menjadi argon-40.
5.Peluruhan Elektron (ε):
Peluruhan elektron mirip dengan peluruhan positron, tetapi melibatkan transformasi neutron menjadi proton dengan melepaskan elektron. Contoh: Peluruhan neutron dalam inti atom boron-12 menjadi proton dengan melepaskan elektron.
6.Peluruhan Spontan: Beberapa inti atom mengalami peluruhan spontan tanpa mengeluarkan partikel tertentu. Peluruhan jenis ini sering melibatkan emisi foton gamma dan kadang-kadang partikel alfa atau beta.
Beberapa aplikasi yang signifikan termasuk
1.Pembangkit Listrik Nuklir:
Peluruhan radioaktif digunakan dalam pembangkit listrik nuklir untuk menghasilkan energi. Reaksi fisi nuklir menghasilkan panas yang digunakan untuk menghasilkan uap, yang kemudian digunakan untuk menggerakkan turbin dan menghasilkan listrik.
2.Pengobatan Kedokteran:
Isotop radioaktif digunakan dalam pengobatan kanker dengan teknik seperti terapi radiasi dan brahiterapi. Selain itu, pemeriksaan medis menggunakan teknik seperti tomografi emisi positron (PET) juga melibatkan isotop radioaktif.
KESIMPULAN
Peluruhan radioaktif, sementara memiliki dampak yang signifikan dalam berbagai aplikasi, memerlukan pendekatan yang hati-hati dalam pemanfaatannya. Keamanan dan pengelolaan limbah menjadi kunci untuk memastikan bahwa manfaat dari peluruhan radioaktif dapat dirasakan tanpa mengorbankan lingkungan dan kesehatan manusia. Dengan pemahaman yang lebih dalam tentang konsep ini, kita dapat mengarahkan penggunaannya menuju solusi yang lebih aman dan berkelanjutan.
DAFTAR PUSTAKA
Fayanto, S., Pati, S., Suwardi, E., Afiudin, A., & Fisika, P. (2016). Peluruhan Zat Radioaktif. Jurnal Praktikum Fisika Modern.https://www.academia.edu/download/51074767/Peluruhan_Zat_Radioaktif.pdf
Safitrianaz, D., Latifah, N., Saragih, P. Y., & Saraswati, D. L. (2019). Analogi Waktu Paruh dan Konstanta Peluruhan (Disintegrasi) Radioaktif. Jurnal Pendidikan Fisika, 7(2), 179-188.https://ojs.fkip.ummetro.ac.id/index.php/fisika/article/viewFile/1780/1217
Mardiana, I., Prihandono, T., & Yushardi, Y. (2019). Kajian Kestabilan Inti Unsur-Unsur Pada Proses Peluruhan Zat Radioaktif Dengan Pendekatan Energi Ikat Inti Model Tetes Cairan. JURNAL PEMBELAJARAN FISIKA, 8(2), 101-106.https://jurnal.unej.ac.id/index.php/JPF/article/download/15212/7511
Suparjo, S. (2014). Menentukan Waktu Paroh dan Konstanta Analogi Disintegrasi Radioaktif dengan Alat Peraga Pembelajaran Analogi Disintegrasi Radioaktif dari Botol Plastik. Jurnal Materi dan Pembelajaran Fisika, 4(1).https://jurnal.fkip.uns.ac.id/index.php/fisika/article/download/5396/3812
Arma, A. J. A., & BAB, I. (2004). Zat Radio Aktif dan Penggunaan Radio Isotop Bagi Kesehatan. Universitas Sumatra Utara, Medan.http://archivecurrikicdn.s3.amazonaws.com/resourcefiles/54d27bfc86e8e.pdf









.png)