Oleh : Muhammad IzzulHaq @W14-IZZULHAQ
Termodinamika merupakan salah satu alat konseptual yang berguna
dalam memahami sains titik paradigma utama termodinamika adalah kesemestaan
hukum-hukumnya sehingga banyak kesimpulan fisik dapat di edukasi dari beberapa
hukum termodinamika melalui Hukum Termodinamika dapat diketahui bahwa suatu
proses kimia akan terjadi atau tidak mungkin terjadi pada kondisi tertentu
sehingga dapat menghemat banyak waktu dan biaya.
Selain itu, Termodinamika juga
berhubungan dengan mekanika statik. Cabang ilmu Fisika ini mempelajari suatu
pertukaran energi dalam bentuk kalor dan kerja, sistem pembatas dan lingkungan.
Aplikasi dan penerapan Termodinamika bisa terjadi pada tubuh manusia, peristiwa
meniup kopi panas, perkakas elektronik, Refrigerator, mobil, pembangkit listrik
dan industri, adalah peristiwa Termodinamika yang paling dekat dengan kehidupan
sehari-hari.
Jadi, sebenarnya ilmu Fisika ini
berkaitan satu sama lain, itulah kenapa memahami setiap konsep itu penting,
karena dengan begitu elo akan mudah memahami hubungan antar keduanya.
Singkatnya, thermodinamika
mempelajari tentang panas dan temperatur, termasuk hubungan keduanya pada
energi dan gerak.
Hukum Dasar Termodinamika terbagi
menjadi 4 yaitu :
1. Hukum Awal(Zeroth Law) Termodinamika
( 0 )
Hukum awal menyatakan bahwa dua
sistem dalam keadaan setimbang dengan sistem ketiga, maka ketiganya dalam
saling setimbang satu dengan lainnya. Hukum ini dimasukkan setelah hukum
pertama.
2. Hukum Pertama Termodinamika
Hukum yang sama juga terkait dengan
kasus kekekalan energi. Hukum ini menyatakan perubahan energi dalam dari suatu sistem termodinamika tertutup sama
dengan total dari jumlah energi kalor yang disuplai ke dalam sistem dan kerja yang dilakukan terhadap sistem. Hukum ini
dapat diuraikan menjadi beberapa proses, yaitu proses dengan Isokhorik,
Isotermik, Isobarik, dan juga adiabatik.
3. Hukum kedua Termodinamika
Hukum kedua termodinamika terkait
dengan entropi. Tidak ada bunyi untuk hukum kedua termodinamika yang ada
hanyalah pernyataan kenyataan eksperimental yang dikeluarkan oleh kelvin-plank
dan clausius. Pernyataan clausius: tidak mungkin suatu sistem apapun bekerja
sedemikian rupa sehingga hasil satu-satunya adalah perpindahan energi sebagai
panas dari sistem dengan temperatur tertentu ke sistem dengan temperatur yang
lebih tinggi. Pernyataan kelvin-planck: tidak mungkin suatu sistem beroperasi
dalam siklus termodinamika dan memberikan sejumlah netto kerja kesekeliling
sambil menerima energi panas dari satu reservoir termal.(sumber Fundamentals of
engineering thermodynamics (Moran J., Shapiro N.M. – 6th ed. – 2007 – Wiley)
Bab5).
” Total entropi dari suatu sistem
termodinamika terisolasi cenderung untuk meningkat seiring dengan meningkatnya
waktu, mendekati nilai maksimumnya hal ini disebut dengan prinsip kenaikan
entropi” merupakan korolari dari kedua pernyataan diatas (analisis Hukum kedua
termodinamika untuk proses dengan menggunakan sifat entropi)(sumber
Fundamentals of engineering thermodynamics (Moran J., Shapiro N.M. – 6th ed. –
2007 – Wiley) Bab6).
4. Hukum ketiga Termodinamika
Hukum ketiga termodinamika terkait
dengan temperatur nol absolut . Hukum ini menyatakan bahwa pada saat suatu
sistem mencapai temperatur nol absolut, semua proses akan berhenti dan entropi
sistem akan mendekati nilai minimum. Hukum ini juga menyatakan bahwa entropi
benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.
Berdasarkan sifat batas
sistem-lingkungan dan perpindahan, kalor dan entropi antara sistem dan
lingkungan, sistem pada termodinamika dibagi menjadi 3, yaitu:
- Sistem Terbuka merupakan pertukaran - pertukaran massa dan energi
sistem dengan lingkungannya lingkungannya.
Misal : lautan, tumbuh-tumbuhan
tumbuha
- Sistem Tertutup Yaitu
pertukaran - pertukaran energi tetapi TIDAK terjadi terjadi pertukaran
pertukaran massa system dengan lingkungannya lingkungannya.
Misalnya Misalnya: Green House Green
House ada pertukaran pertukaran kalor tetapi tidak terjadi terjadi pertukaran
kerja pertukaran kerja dengan lingkungan lingkungan.
- Sistem Terisolasi Yaitu tidak ada
pertukaran pertukaran massa dan energi sistem dengan lingkungan lingkungan.
Misalnya Misalnya: Tabung gas yang
gas yang terisolasi.
ENERGI PADA REAKSI KIMIA (TERMOKIMIA)
Pengertian
Termokimia adalah cabang ilmu kimia
yang memperhatikan aspek suhu dalam reaksi. Sistem
adalah segala bentuk proses yang menjadi pusat perhatian pengamat. Contoh:
keadaan zat, reaksi, perubahan zat. Sistem terdiri dari :
1) Sistem terbuka, yaitu sistem
dapat mengalami pertukaran energi dan materi dengan lingkungan.
2) Sistem tertutup, yaitu sistem
dapat mengalami pertukaran energi dengan lingkungan, tidak dengan pertukaran
materi.
3) Sistem terisolasi, yaitu sistem
tidak dapat mengalami pertukaran energi dan materi dengan lingkungan.
Reaksi Eksoterm dan Endoterm
Dalam konsep termokimia, reaksi
terbagi menjadi dua, yaitu reaksi eksoterm dan reaksi endoterm.
1. Reaksi eksoterm, yaitu reaksi
yang sistemnya membebaskan/melepas energi, sehingga lingkungan menjadi naik
temperaturnya. Contoh: reaksi diatas suhu kamar (pembakaran), pelarutan NaOH,
reaksi Mg dengan HCl.
2. Reaksi endoterm, yaitu reaksi
yang sistemnya menyerap/menerima energi, sehingga lingkungan menjadi turun
temperaturnya. Contoh: reaksi Ba(OH)2 dengan NH4Cl, pemanasan CuCO3.
Dalam kedua reaksi, terjadi perubahan tingkat energi yang
disebut perubahan entalpi reaksi, dapat dihitung :
Diagram tingkat energi menunjukkan nilai perubahan entalpi
reaksi.
Entalpi reaksi ditentukan dengan:
1) Menggunakan
kalorimetri.
2) Menggunakan
hukum Hess (penjumlahan).
3) Menggunakan
data entalpi pembentukan.
4) Menggunakan data energi ikatan.
Kalorimeter adalah sistem terisolasi, sehingga semua energi yang dibutuhkan atau dibebaskan tetap berada dalam kalorimeter. Dengan mengukur perubahan suhu, kita dapat menentukan jumlah energi kalor reaksi dan entalpi reaksi :
Menurut hukum Hess, suatu reaksi dapat terjadi melalui beberapa tahap reaksi, dan bagaimanapun tahap atau jalan yang ditempuh tidak akan mempengaruhi entalpi reaksi. Perubahan entalpi reaksi menurut hukum Hess:
1) Hanya
tergantung pada keadaan awal dan akhir sistem, bukan tahap yang ditempuh.
2) Merupakan
penjumlahan entalpi reaksi dari setiap tahap.
Contoh :
Tentukan
perubahan entalpi penguapan air dari wujud padat jika diketahui reaksi-reaksi
berikut:
H2(g) + 1
/2O2(g) → H2O(g) ΔH = -241,8 kJ
H2O(l) → H2O(s)
ΔH = -6,01 kJ
H2(g) + 1
/2O2(g) → H2O(l) ΔH = -285,8 kJ
Jawab :
Reaksi yang diinginkan: H2O(s) → H2O(g) Berarti, seluruh H2O(s) diletakkan disebelah kiri (reaktan), dan H2O(g) diletakkan disebelah kanan (produk), sehingga ketiga reaksi diatas menjadi:
Dari konsep hukum Hess, energi kalor suatu reaksi berarti juga dapat ditentukan dari data entalpi pembentukan reaktan dan produknya.
Bentuk reaksi umum:







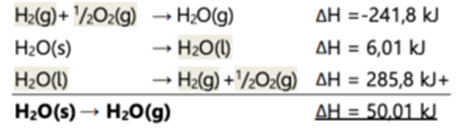

Tidak ada komentar:
Posting Komentar
Catatan: Hanya anggota dari blog ini yang dapat mengirim komentar.