Oleh : Debi kurniawan ( @W05-DEBI )
Abstrak
:
Energi menjadi sebuah
istilah yang sangat umum digunakan dalam kehidupan sehari-hari, mulai dari
makanan, minuman, olahraga, Kesehatan, bahkan sampai pada industry dan
pembangkit listrik. Sering kita mendengar istilah energi, tapi apakah kita
benar-benar memahami apa itu energi? Jenis-jenis energi?, dalam hal ini saya
mencoba untuk memberikan sedikit pemahaman konsep dasar energi dalam
termodinamika secara sederhana.
Definisi Sederhana
Secara sederhana, definisi
dari energi itu sendiri adalah kemampuan untuk menghasilkan usaha. Jika dalam
ilmu fisika, suatu usaha dapat diartikan sebagai gaya yang dilakukan untuk
melakukan oemindahan suatu benda sejauh karak tertentu. Sehingga dengan kata
lain, segala sesuatu yang berpindah menandakan kepemilikan terhadap sebuah
energi.Akan tetapi, bukan berarti jika tidak ada perpindahan, menandakan tidak
adanya energi.
Kalor adalah perpindahan energi termal. Kalor mengalir dari satu bagian
sistem yang suhunya lebih tinggi ke sistem yang suhunya lebih rendah. Ketika
sistem yang suhunya lebih tinggi bersentuhan dengan sistem yang suhunya lebih
rendah, maka partikel-partikel dalam kedua sistem tersebut bertumbukan.
Sedangkan kerja merupakan sistem yang mengalami pergeseran akibat beraksinya
gaya. Jika hasil sistem secara keseluruhan menimbulkan gaya pada lingkungannya
dan terjadi pergeseran, maka kerja yang dilakukan oleh sistem atau pada sistem
disebut kerja eksternal.
Awalnya
kalor dianggap sebagai zat alir (fluida) tanpa bobot dan tidak dapat dilihat.
Kalor timbul jika ada bahan yang dibakar. Kalor dapat berpindah dari benda yang
satu ke benda lainnya dengan cara konduksi, konveksi, dan atau radiasi.
Seperti
pengalaman Count Rumford dan Sir James Prescott Joule dalam
pengeboran laras meriam dan percobaan-percobaannya, dapat disimpulkan bahwa
energi mekanik terus menerus berubah wujudnya menjadi kalor. Hal ini berarti terdapat
kesetaraan antara energi mekanik dengan kalor. Dalam percobaannya Joule
menemukan, bahwa 4,186 joule (J) setara dengan 1 kalori. Jadi
1,000 kal = 4,186 J.
Terjadinya
proses perubahan energi mekanik menjadi kalor menjadi salah satu contoh adanya
keteapan energi dan sebaliknya, juka kalor dapat diubah menjadi energi mekanik,
sehingga kalor merupakan salah satu bentuk energi mekanik.
Dalam
hal kalor dapat dibedakan dua konsep pokok, yaitu:
1. Rasa
kepanasan (hot) yang disebut temperatur atau suhu.
2. Besaran
yang dapat menyebabkan adanya perubahan temperatur yang disebut kalor (heat)
atau bahang.
Hukum I Termodinamika ( Kekekalan
energi )
Yaitu
energi yang diserahkan sama dengan energi yang diterima namun tidak pernah
terjadi, banyak hukum alam yang ada disekitar kita yang sering terjadi tapi
tidak memenuhi hukum kekekalan energi. Hukum I
Termodinamika dapat diaplikasikan pada sistem gas ideal, untuk menentukan
tekanan, volume, temperatur, perubahan energi internal suatu sistem yang
menjalani suatu proses.
Hukum II.Termodinamika ( arah
kesepontanan reaksi )
Hukum II Termodinamika diwakilkan oleh Entropi, dimana Entropi merupakan
fungsi koordinat Termodinamika. Perubahan entropi semesta , (ketaksamaan
menyatakan proses irreversibel sedangkan tanda = untuk proses reversibel). Hukum
II Termodinamika dapat diaplikasikan pada sistem gas ideal dan gas real untuk
menentukan perubahan entropi sistem, lingkungan semesta untuk proses reversibel
dan irreversibel.
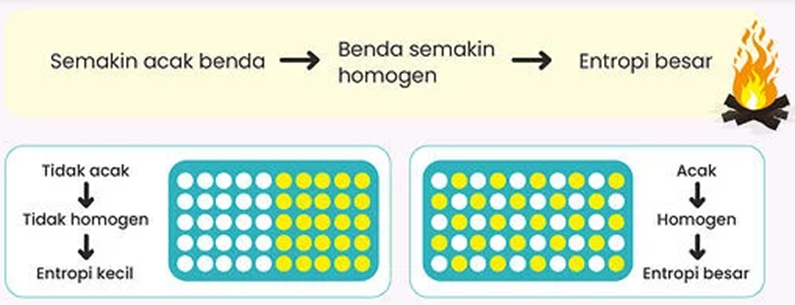
Secara
alamiah (spontan), sistem akan selalu mengarah kepada homogen (menjadi lebih
acak), sehingga entropi akan selalu semakin besar ( perubahan entropi
positif ). Ketika terjadi perbedaan suhu, maka sistem akan selalu menuju
suhu yang homogen (kesetimbangan termal).
Penyebab :
- Penurunan entalpi
Reaksi eksotermik kebanyakan memiliki sifat spontan
- Kenaikan Entropi (ketidakteraturan )
Factor yang mendorong reaksi akan spontan adalah entropi akan naik
Proses yang cukup dekat dengan reversible yaitu prose
perubahan fasa dan proses pemanasan/pendinginan zat
Factor-faktor yang mempengaruhi nilai entropi yaitu :
- Volume
- Suhu, jika suhu lebih besar maka entropi akan lebih besar.
- Wujud fisik
Jumlah mol, karena entropi adalah besaran ekstensif.
Pendahuluan dan konsep
dasar Termodinamika
Temodinamika merupakan suatu keilmuan
yang sangat dekat dengan kehidupan kita, dimana ilmu ini mempelajari hubungan
antara energi dan kerja dari suatu sistem. Termodinamika hanya mempelajari
besaran-besaran yang berskala besar (makroskopis) dari sistem yang dapat
diamati dan diukur dalam eksperimen. Besaran-besaran yang berskala kecil (mikroskopis)
dipelajari dalam Teori Kinetik Gas (Kinetic Theory of Gas) atau Fisika
Statistik (Statistical Physics).
1. Termodinamika
dan energi
Termodinamika dapat didefinisikan sebagai sains dari energi. Temodinamika berasal dari Bahasa Yunani therme (heat/kalor) dan dynamics (power/daya) sehingga dapat dikatakan termodinamika mengubah kalor menjadi daya / kerja. Hukum pertama termodinamika yaitu hukum kekelan energi, energi merupakan besaran property dari termodinamika. Hukum kedua termodinamika yaitu energi memiliki kualitas dan kuantitas, dari suatu proses berlangsung pada arah yang kualitasnya berkurang.
Termodinamika terbagi menjadi 2
kajian yang dapat kita pelajari yaitu :
Termodinamika klasik
yang merupakan pendekatan termodinamika yang tidak perlu memperhitungkan
kelakuan dari partkel penyusun. Kajian ini berifat macroscofic myang
membahas tentang tekanan (P), volume (V), dan temperature (T).
Termodinamika statistic
yaitu pendekatan termodinamika yang memperhitungkan sifat rata-rata dari
partikel penyusun. Atau dapat dikatakan juga sebagai kajian microscofic, yang
membahas tentang tumbukan antar partikel
Contoh aplikasi dari temodinamika
dalam kehidupan sehari-hari seperti : lemari pendingin, turbin angin, power
plant, mesin mobil dan pressure cooker.
2. Sistem
dan control volume
- Sistem, Lingkungan dan Batas
Sistem merupakan kuantitas atau
materi yang dipilih untuk dipelajari. Daerah luar sistem dinamakan dengan
lingkungan (surroundings). Permukaan riil atau imajiner yang mengisahkan
antara sistem dan lingkungan dinamakan batas (boundary), batas tersenut
dapat berupa batas yang tetap (fixed)atau batas yang bergerak.
Dalam Analisa sederhana, misalnya kta dapat mengasumsikan bahwa batas tersebut memiliki ketebalan nol, tidak bermassa, dan tidak bervolume.
Sistem tertutup
dinamakan control massa. Pada sistem ini tidak terjadi pertukaran massa antara
sistem dan lingkungan, namun hanya terjadi pertukaran energi.
Sistem terbuka
dinamakan control volume. Pada sistem ini dapat terjadi pertukaran massa dan
energi antara sistem dan lingkungan.
Sistem terisolasi :
Ketika tidak terjadi pertukaran massa dan energi anatara sistem dan lingkungan.Oleh
sebab itu, pada Analisa engineering, sistem ini harus terdefinisi dengan jelas.
3. Property,
keadaan dan kesetimbangan
v Properti
( Besaran )
Karakter dari sebuah sistem dinamakan
property (besaran), Properti yang familiar dalam mempelajari termodinamika
yaitu tekanan (P), temperature (T), volume (V), massa (m) dan energi (E).
Properti atau besaran pada termodinamika
terbagi menjadi dua macam, yaitu :
Properti intensif ( tidak tergantung
massa ) seperti ; temperature, tekanan,dan rapat massa.
Properti ekstensif ( bergantung pada
massa ) seperti; massa total, volume total. Properti ekstensif per unit massa
dinamakan dengan property spesifik, volume spesifik, dan energi spesifik.
v Keadaan
Keadaan (state), yaitu ketika
sistem dalam kondisi tidak berubah. Pada suatu keadaan, property dari suatu
sistem dapat dihitung atau diukur dan memiliki intensitas nilai yang tetap ( fixed
).
Keadaan steimbang ( equilibrium
). Suatu sistem dapa dinyatakan setimbang ketika tidak ada potensi yang tidak
Simbang ( unbalanced ). Beberapa jenis kesetimbangan dalam termodinamika
diantaranya; kestimbangan termal, kesetimbangan mekanik, kesetimbangan fasa dan
kesetimbangan kimia.
v Postulat
keadaan
Keadaan suatu sistem terkompresi yang
dapat dideskripsikan oleh dua property intensif yang saling independen. Dua
property dikatakan independen, jika salah satu property dapat diubah, sedangkan
property yang lain dapat dipertahankan secara konstan.
4. Proses
dan siklus
Proses adalah perubahan suatu sistem
dari satu keadaan setimbang lainnya. Rangkaian keadaan yang dilewati sepanjang
proses dinamakan jalur ( path ).
Proses kuasi-statik ( quasi-static )
atau kuasi-setimbang ( Quasi-equilibrium ) dalah proses yang berlangsung sangat
lamban, dimana sistem dapat berubah secara internal sedimikian rupa hingga semua bagian pada sistem berubah
bersamaan.
Beberapa tipe proses yang dapat terjadi diantaranya : isothermal, isokhorik, isobaric dan adabatik.
Siklus sitem dapat dikatakan mengalami siklus, jika proses yang berlangsung kembali pada keadaan semula :
5. Hukum ke-nol termodinamika
Hukum ke-nol termodinamika adalah jika
terdapat dua benda yang setimbang dengan benda ketiga, maka kedua benda
tersebut dapat dinyatakan setimbang termal. Konsep temperature dan alat ukur
sush yaitu dua benda berada dalam kesetimbangan termal jika kedua benda
tersebut memiliki temperature yang sama.
Dalam mempelajari energi dalam termodinamika tentu kita harus
benar-benar paham terlebih dahulu apa saja yang dapat menjadi faktor terjadinya
proses didalam kimia tersebut. mulai dari material, properti, sistem, volume,
temperatur, tekanan yang terjadi. Sehingga kita akan lebih mudah dalam memahami
dan memperlakukan unsur-unsur kimia yang ada dilingkungan sekitar kita.
Referensi :
http://karya-ilmiah.um.ac.id/index.php/fisika/article/view/17270
https://indonesiare.co.id/id/article/energi-dalam-kaidah-ilmu-termodinamika
http://staff.uny.ac.id/sites/default/files/Diktat%20Termodinamika.pdf






Tidak ada komentar:
Posting Komentar
Catatan: Hanya anggota dari blog ini yang dapat mengirim komentar.