Kesetimbangan Kimia: Jenis Jenis, Persamaan Reaksi, dan Tetapan
Oleh : Rifki Alfarizi (@V25-Alfarizi)
Ketika ada seseorang berbelanja kepasar membeli beras sebanyak 1 kg, lalu pedagang akan mengukur dengan anak timbangan yang memiliki massa sebesar 1 kg pula, kan? Tentu saja pedagang tersebut juga akan memastikan agar berat beras dapat seimbang dengan anak timbangan. kasus ini merupakan salah satu contoh dari kesetimbangan kimia. Semua benda yang diam dan tidak bergerak dapat dikatakan selalu ada di dalam keadaan setimbang. Kesetimbangan kimia adalah keadaan saat kedua reaktan dan produk hadir dalam konsentrasi yang tidak memiliki kecenderungan lebih lanjut untuk berubah seiring berjalannya waktu.
Pengertian Kesetimbangan Kimia
Perhatikan reaksi di bawah ini!
A + B --> C
Jika A kita ibaratkan sebagai terigu, lalu akan kita campurkan dengan B kita misalkan sebagai telur, maka C kita ibaratkanlah sebagai adonan. A dan B yang posisinya di sebelah kiri panah bolak-balik kita sebut reaktan. Apabila A dan B tadi bercampur membentuk C berlangsung 10 menit. Setelah 10 menit A dan B sudah tak ada karena semuanya sudah membentuk C. C yang ada di sebelah kanan panah disebut produk. Jadi setelah 10 menit adonan terbentuk. Reaksi seperti ini disebut reaksi searah. Atau kalau hasil sudah terbentuk berarti reaksi sudah selesai. Jadi adonan atau si C adalah endingnya.

By food.detik.com
Contoh reaksi ini adalah, besi yang berkarat, kertas yang terbakar nasi yang berubah jadi basi. Semua reaksi itu reaksi 1 episode langsung tamat.
Nah, tapi ada juga reaksi kimia yang bolak balik, kok bisa bolak balik ya ?
Begini, misalkan reaksi yang tadi kan A campur B membentuk C, nah jika ternyata beberapa detik kemudian, si C balik lagi membentuk A dan B maka reaksi inilah yang disebut reaksi bolak- balik, bahasa kerennya reversibel.
Jadi andaikan adonan kue bisa berpisah kembali jadi terigu dan adonan secara utuh, nah berarti reaksi membuat kue adalah reversibel ye kan? Tapi gamungkin dong bisa balik lagi kan wkwkwk.
Reaksi bolak balik Kalau ditulis seperti ini nih bentuk reaksinya. Ada panah dengan dua arah.
A + B <==> C
Setelah beberapa detik A dan B terbentuk, eh dia balik lagi C, begitu terus sebaliknya. Reaktan jadi produk, balik lagi produk jadi reaktan.
Komponen sebelah kiri panah adalah reaktan atau pereaksi, mereka semakin lama semakin berkurang saat akan membentuk C. Laju A dan B Disebutnya laju pengurangan.
Kemudian C semakin lama semakin bertambah sehingga laju reaksi nya disebut laju pertambahan.
Perhatikan, ini dia grafiknya.
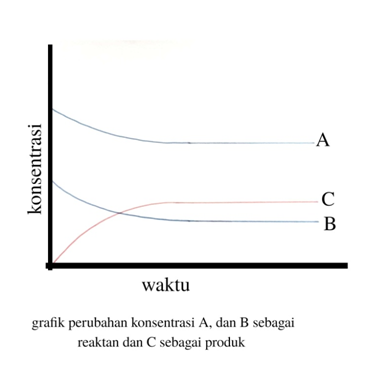
Garis A dan B terlihat turun, karena mereka berkurang dan mengalami laju pengurangan, sementara garis C terlihat naik, karena C bertambah dan mengalami laju pertambahan.
Mengenai laju reaksinya, laju reaksi untuk laju pengurangan berarti berkurangnya zat tersebut dalam hitungan waktu (detik). Jika laju pertambahan berarti bertambahnya suatu zat dalam hitungan waktu.
Simpelnya begini, misalkan si A asalnya 4 mol. Oh iya, mol adalah satuan yang biasa digunakan dalam reaksi kimia.
Nah setelah 10 detik eh tinggal 2 mol berarti laju pengurangan A tinggal kita kurangi aja
Laju A = (mol akhir - mol awal)/detik
Laju A = (4 mol - 2 mol)/10 detik
Laju A = 0,2 mol/detik
Jika kita bicara laju pertambahan berarti ya nyaris sama , kita menghitung selisih mol awal dan mol akhir, setelah itu dibagi waktu.
Laju C = mol akhir - mol awal
Konsep Dasar Kesetimbangan Kimia
Kita lihat lagi reaksi pembentukkan C dari A dan B memiliki reaksi kesetimbangan:
A + B <==> C
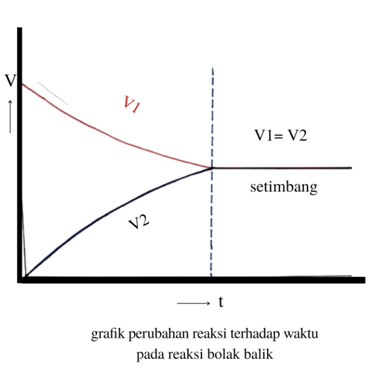
Kaitannya pada kesetimbangan reaksi di atas, Kesetimbangan kimia terjadi apabila laju pengurangan A dan B sama dengan laju pertambahan C. Meskipun mungkin hanya sesaat namun seolah-olah reaksi berhenti saat laju pengurangan dan laju pembentukan sama. Tapi ini tingkat makroskopis (secara kasat mata) ya, sebenarnya tingkat mikroskopis alias molekul reaksi tetap berlangsung.
Faktor-faktor yang Mempengaruhi Kesetimbangan
Henri Louis Le Chatelier (1850-1936) Dia mempunyai teori bahwa :
”Bila terhadap suatu kesetimbangan dilakukan suatu tindakan (aksi) maka sistem itu akan mengadakan reaksi yang cenderung mengurangi pengaruh aksi tersebut”
Caranya dia bisa geser ke kiri yaitu arah reaktan atau geser ke kanan yaitu arah produk.
Nah apa saja faktor-faktor yang mempengaruhi pergeseran kesetimbangan?
Jenis-Jenis Kesetimbangan Kimia
Kesetimbangan kimia terdiri atas dua macam, yaitu kesetimbangan statis dan kesetimbangan dinamis. Kesetimbangan statis terjadi jika reaksi kimia yang dihasilkan merupakan reaksi kimia satu arah atau reaksi kimia yang tidak dapat kembali lagi seperti semula.
Sedangkan kesetimbangan dinamis terjadi jika reaksi kimia yang dihasilkan merupakan reaksi kimia dua arah atau reaksi kimia yang bisa kembali lagi seperti semula.
Ketika kamu membakar selembar kertas, abu yang dihasilkan tidak dapat berubah menjadi kertas lagi. Hal ini termasuk contoh kesetimbangan statis.
Akan tetapi, walau sama-sama menghasilkan reaksi, air yang direbus hingga menghasilkan uap akan memberi reaksi yang berbeda dengan kertas yang dibakar menjadi abu. Mengapa? Sebab, jika uap terkena tutup panci atau benda lainnya maka akan berubah kembali menjadi air. Nah, hal ini disebut dengan kesetimbangan dinamis karena ada perubahan dua arah.

Air yang direbus dalam panci tertutup (Sumber: wikipedia.org)
Kesetimbangan dinamis bekerja saat kecepatan reaksi pembentukan produk sama dengan kecepatan pembentukan reaktan. Ingat, dalam kesetimbangan dinamis akan selalu ada perubahan menuju produk dan perubahan kembali menjadi reaktan. Kesetimbangan dinamis dilambangkan dengan tanda panah dua arah (⇌).
Persamaan Reaksi Kesetimbangan Kimia
Jika suhu tetap gas A berada dalam kondisi setimbang dengan gas B, maka persamaan reaksinya dapat ditulis sebagai berikut:
aA(g) ⇌ bB(g)
Apabila gas A dalam keadaan setimbang dengan gas B, maka kecepatan pembentukan gas B pasti sama dengan kecepatan pembentukan kembali gas A. Sudah paham kan? Nah, tiap gas A berubah sebanyak a mol, maka B juga akan berubah sebanyak b mol. Perbandingan mol A dan mol B akan selalu tetap.
Tetapan Kesetimbangan Kimia
Merupakan angka yang menunjukkan perbandingan secara kuantitatif antara produk dengan reaktan. Secara umum reaksi kesetimbangan dapat dituliskan sebagai berikut.
aA + bB ⇌ cC + dD
Saat di dalam reaksi kesetimbangan dilakukan aksi, maka kesetimbangan akan bergeser dan sekaligus mengubah komposisi zat-zat yang ada untuk kembali mencapai kesetimbangan. Secara umum dapat dikatakan tetapan kesetimbangan merupakan perbandingan hasil kali molaritas produk dengan hasil kali molaritas reaktan yang masing-masing dipangkatkan dengan koefisiennya.
Referensi :
https://youtu.be/9XuUic3EklY
https://www.zenius.net/blog/materi-kesetimbangan-kimia
https://ocw.ui.ac.id/mod/resource/view.php?id=8510
Tidak ada komentar:
Posting Komentar
Catatan: Hanya anggota dari blog ini yang dapat mengirim komentar.