Oleh : Clara Elva Novita (@T04-Clara)
ABSTRAK
Kesetimbangan kimia terjadi ketika sebuah reaksi berlangsung secara reversible. Kesetimbangan ini bersifat dinamis yang terjadi pada kesetimbangan homogen dan kesetimbangan heterogen. Dalam kesetimbangan kimia, terdapat tetapan kesetimbangan kimia yang mempunyai maknanya sendiri. Kesetimbangan kimia dipengaruhi oleh beberapa faktor, yaitu konsentrasi, volume, tekanan, dan suhu yang mengakibatkan pergeseran kesetimbangan atas dasar asas Le Chatelier. Manfaat dari kesetimbangan kimia dapat dijumpai pada bidang industri, seperti pada pembuatan amonia dan pembuatan H₂SO₄.
Kata kunci
: kesetimbangan kimia, tetapan , pergeseran.
ABSTRACT
Chemical equilibrium occurs when a reaction is reversible. This equilibrium is dynamic which occurs in homogeneous equilibrium and heterogeneous equilibrium. In chemical equilibrium, there is a chemical equilibrium constant which has its own meaning. Chemical equilibrium is influenced by several factors, namely concentration, volume, pressure, and temperature which result in a shift in equilibrium on the basis of Le Chatelier's principle. The benefits of chemical equilibrium can be found in industrial fields, such as in the manufacture of ammonia and the manufacture of H₂SO₄.
Keywords : chemical equilibrium, constant, shift.
PENDAHULUAN
Berdasarkan arah reaksi, reaksi kimia dibagi menjadi
dua, yaitu reaksi irreversible (satu arah) dan reaksi reversible (bolak-balik).
Kesetimbangan kimia adalah hal yang terjadi ketika suatu reaksi berlangsung
secara bolak-balik. Reaksi ini terjadi di dalam sistem tertutup, yaitu ketika
zat-zat yang bereaksi dan zat-zat hasil reaksi tidak ada yang meninggalkan sistem.
Kesetimbangan ini bersifat dinamis, karena secara makroskopis tidak terjadi
perubahan, tetapi secara mikroskopis reaksi berlangsung terus menerus dalam dua
arah dengan laju reaksi pembentukan sama dengan laju reaksi penguraian.
Menurut Guldberg dan Waage (1866),
bahwa kesetimbangan
kimia adalah proses yang dinamis di mana laju reaksi untuk reaksi maju dan
mundur harus sama pada kesetimbangan kimia.
Di dalam kesetimbangan kimia, ada kesetimbangan homogen
dan kesetimbangan heterogen. Kesetimbangan homogen adalah kesetimbangan yang
semua komponennya satu fasa. Contoh :
N₂ (g) + H₂ (g) ⇌ 2NH₃ (g)
Sedangkan,
kesetimbangan heterogen adalah kesetimbangan yang terdiri dari dua fasa atau
lebih. Contoh :
C₄CO₃ ⇌ CaO (s) + CO₂ (g)
RUMUSAN MASALAH
1.
Apa saja yang
terdapat pada tetapan kesetimbangan ?
2.
Bagaimana makna
tetapan kesetimbangan ?
3.
Bagaimana
perhitungan tetapan kesetimbangan ?
4.
Apa saja faktor
yang memengaruhi pergeseran kesetimbangan kimia ?
5.
Bagaimana
penerapan kesetimbangan kimia dalam industri ?
TUJUAN
1.
Untuk mengetahui
hal yang terdapat pada tetapan kesetimbangan.
2.
Untuk memahami makna
tetapan kesetimbangan.
3.
Untuk mengetahui
cara perhitungan tetapan kesetimbangan.
4.
Untuk mengetahui
faktor yang memengaruhi pergeseran kesetimbangan kimia.
5.
Untuk memahami
penerapan kesetimbangan kimia dalam industri.
PEMBAHASAN
Pada saat reaksi sudah mencapai keadaan setimbang,
nilai konsentrasi pereaksi dan konsentrasi produk ditentukan oleh nilai
perbandingan stoikiometri. Pada reaksi kimia :
m A (g) + n B (g) ⇌
p C (g) + q D (g)
Dimana m, n, p, dan q adalah koefisien zat pereaksi, sedangkan A, B, C, dan D adalah zat pereaksi. Saat Guldberg dan Waage meneliti beberapa reaksi kesetimbangan, mereka menemukan persamaan yang bentuknya sama dengan quotient (Q) reaksi dan harganya hanya dipengaruhi oleh suhu . Persamaan ini dikenal dengan nama hukum kesetimbangan atau hukum aksi massa. Persamaan itu dapat dinyatakan sebagai berikut :
Kc
adalah harga konstanta tetapan kesetimbang. Menurut Nurissalam (2012), bahwa
harga tetapan K memberikan petunjuk tentang banyaknya hasil reaksi yang dapat
terbentuk pada suatu reaksi kesetimbangan. Nilai Kc memiliki hubungan dengan Qc
yang memprediksi arah reaksi. Saat nilai Qc < Kc, maka reaksi berlangsung ke
arah kanan sampai Qc = Kc. Sedangkan, ketika nilai Qc > Kc, maka reaksi
berlangsung ke arah kiri sampai Qc = Kc.
Untuk reaksi yang melibatkan sistem gas, harga K dapat
dinyatakan dalam tetapan kesetimbangan tekanan parsial gas, yaitu :
Pada
reaksi-reaksi kesetimbangan yang melibatkan gas, tekanan parsial gas berbanding
lurus dengan konsentrasinya. Kp dan Kc juga mempunyai hubungan yang dapat
dirumuskan:
Kp
= tetapan kesetimbangan dalam tekanan (atm)
Kc
= tetapan kesetimbangan dalam konsentrasi (mol/lt)
R
= tetapan gas umum = 0,082 lt atm/mol K
T
= suhu (kelvin)
∆n= jumlah koefisien hasil –jumlah koefisien pereaksi
Tetapan kesetimbangan ini mempunyai makna yang
penting. Dengan tetapan kesetimbangan ini, kita dapat menentukan apakah suatu
reaksi bolak-balik berada dalam keadaan setimbang, menentukan komposisi zat-zat
dalam keadaan setimbang, dan memprediksi arah reaksi.
Menurut Ismunandar (2013), bahwa posisi kesetimbangan
itu unik, artinya untuk reaksi tertentu dan suhu tertentu, pasti posisi
kesetimbangan dapat dicapai dari arah reaktan maupun produk.
Nilai perhitungan tetapan kesetimbangan bisa
menggunakan rumus Kc, tetapi terkadang ada reaksi yang konsentrasi
masing-masing zatnya belum diketahui seluruhnya dan hanya diketahui harga
derajat disosiasi. Jika hal itu terjadi, maka kita bisa menggunakan rumus :
Ket
:
α = 0, tidak terdisosiasi
α = 1, terdisosiasi sempurna
0 < α < 1, keseimbangan
Nilai
suatu tetapan kesetimbangan bisa dimanipulasi dengan beberapa aturan, seperti :
1.
Jika beberapa
reaksi dijumlahkan, maka :
Kc’ = Kc₁ x Kc₂ x Kc₃ x ... x Kcn
2. Jika suatu reaksi dibalik, maka :
Kc’ = 1/Kc
Saat reaksi sudah mencapai kesetimbangan, ada beberapa
faktor yang bisa menyebakan kesetimbangan itu bergeser. Hal ini disebut
pergeseran kesetimbangan yang didasari oleh asas Le Chatelier. Menurut asas Le
Chatelier, jika suatu kesetimbangan dilakukan suatu tindakan, maka kesetimbangan
tersebut akan mengalami perubahan. Faktor-faktor yang memengaruhu perubahan tersebut
adalah :
a.
Konsentrasi
Jika konsentrasi
ditambah, maka kesetimbangan akan bergeser dari arah zat tersebut. Sedangkan,
jika konsentrasi dikurangi maka kesetimbangan akan bergeser ke arah zat
tersebut.
b. Suhu
Menurut Maisaroh
dan purwanto (2019), bahwa pergeseran
kesetimbangan reaksi kimia antara lain dipengaruhi oleh suhu reaksi.
Kesetimbangan kimia terjadi apabila kecepatan reaksi ke kanan sama dengan
kecepatan reaksi ke kiri. Bila dalam suatu reaksi eksotermis dilakukan
perubahan suhu reaksi, maka kesetimbangan reaksi kimia akan bergeser ke arah
reaksi endotermik (ke arah kiri), sehingga produk yang terbentuk menjadi
berkurang. Jadi, jika suhu dinaikkan, maka
kesetimbangan akan bergeser ke reaksi endoterm. Sedangkan, jika suhu
diturunkan, maka kesetimbangan akan bergeser ke reaksi eksoterm.
c. Volume
Jika volume
diperbesar, maka kesetimbangan akan bergeser ke jumlah koefisien besar.
Sedangkan, jika volume diperkecil, maka kesetimbangan akan bergeser ke jumlah
keofisien kecil.
d. Tekanan
Jika tekanan diperkecil, maka
kesetimbangan akan bergeser ke jumlah koefisien besar. Sedangkan, jika tekanan
diperbesar, maka kesetimbangan akan bergeser ke jumlah koefisien kecil.
Banyak
yang berasumsi kalau katalis dapat memengaruhi letak kesetimbangan. Padahal,
katalis hanya mempercepat tercapainya keadaan setimbang dan tidak memengaruhi
letak kesetimbangan.
Manfaat dari kesetimbangan kimia ini sangatlah banyak,
contohnya dalam bidang industri. Di dalam bidang industri, contohnya :
1.
Pembuatan amoniak
(proses Haber Bosch)
2.
Pembuatan asam sulfat (proses kontak)
3.
Pembuatan asam nitrat (metode Ostwald)
KESIMPULAN
Tetapan kesetimbangan kimia adalah Kc. Sedangkan, untuk
reaksi yang melibatkan sistem gas, harga K dapat dinyatakan dalam tetapan
kesetimbangan tekanan parsial gas. Makna tetapan kesetimbangan bisa memprediksi
arah reaksi, menentukan komposisi zat, dan menentukan reaksi dalam keadaan
setimbang atau tidak. Di dalam kesetimbangan, bisa terjadi pergeseran
kesetimbangan kimia yang disebabkan oleh beberapa faktor, yaitu suhu, tekanan,
konsentrasi, dan volume. Dalam fungsinya, kesetimbangan kimia digunakan dalam
bidang industri untuk memproduksi berbagai macam zat.
DAFTAR PUSTAKA
Hidayat,
Atep Afia. 2021. Kesetimbangan Kimia.
Modul Perkuliahan Kimia dan Pengetahuan Lingkungan Industri. Jakarta:
Universitas Mercu Buana.
Ismunandar.
2013. Kimia Dasar II : Kesetimbangan. Bandung:
ITB. Dalam https://youtu.be/9XuUic3EklY (diunduh 19
September 2021)
Maisaroh.,
Purwanto, Wahyu. 2019. Tinjauan Termodinamika dan Kesetimbangan Kimia Dalam Hubungan
Perubahan Suhu Terhadap Konversi Reaksi Epoksidasi Asam Oleat Berbasis Sawit. Prosiding
Seminar Nasional Pengabdian Masyarakat LPPM UMJ. Dalam https://jurnal.umj.ac.id/index.php/semnaskat/article/download/5381/3594 (diunduh 19 September 2021)
Nurissalam,
Muhamad. 2012. Kesetimbangan Kimia (Equilibrium Chemistry) Dalam Pengairan. TAPAK Vol.2 No.1. Dalam https://ojs.ummetro.ac.id/index.php/tapak/article/download/216/172 (diunduh 19 September 2021)

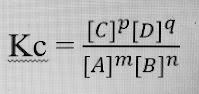




Tidak ada komentar:
Posting Komentar
Catatan: Hanya anggota dari blog ini yang dapat mengirim komentar.