Rafli Imam Madluthfi (@Z12-RAFLI)
Abstrak
Tabel periodik, adalah tampilan
tabular dari unsur-unsur kimia. Tabel ini banyak digunakan dalam kimia, fisika, dan ilmu-ilmu lainnya,
dan umumnya dipandang sebagai ikon dari kimia. Tabel ini merupakan rumusan
grafik dari hukum periodik, yang menyatakan bahwa sifat-sifat unsur kimia
menunjukkan ketergantungan periodik pada nomor atomnya.
Tabel ini
dibagi menjadi empat area persegi panjang yang disebut blok.
Baris-baris tabel disebut periode,
dan kolom-kolomnya disebut golongan.
Unsur-unsur dari golongan yang sama dari tabel periodik menunjukkan
karakteristik kimia yang serupa. Tren berjalan melalui tabel periodik, dengan karakter nonlogam (menjaga
elektronnya sendiri) meningkat dari kiri ke kanan dalam satu periode, dan dari
bawah ke atas melintasi satu golongan, dan karakter logam (menyerahkan elektron ke atom lain) meningkat
ke arah yang berlawanan. Alasan yang mendasari tren ini adalah konfigurasi elektron atom.
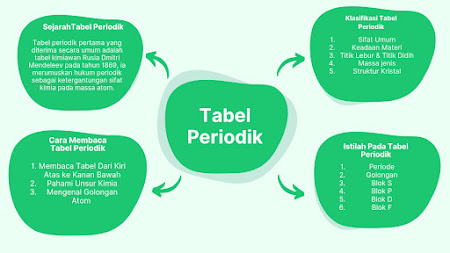
Tabel periodik pertama yang diterima secara umum adalah tabel
kimiawan Rusia Dmitri Mendeleev pada
tahun 1869, ia merumuskan hukum periodik sebagai ketergantungan sifat kimia
pada massa atom. Karena dahulu tidak semua unsur diketahui, ada celah dalam
tabel periodiknya, dan Mendeleev berhasil menggunakan hukum periodik
untuk memprediksi sifat berupa unsur yang hilang. Hukum
periodik diakui sebagai penemuan mendasar pada akhir abad ke-19, dan dijelaskan
dengan penemuan nomor atom dan karya perintis dalam mekanika kuantum pada
awal abad ke-20 yang menerangi struktur internal atom. Dengan penemuan Glenn T. Seaborg pada
tahun 1945 bahwa aktinida sebenarnya
adalah unsur blok-f dan bukannya unsur blok-d, bentuk tabel yang dikenali dapat
dicapai. Tabel periodik dan hukum sekarang menjadi bagian sentral dan tak
terpisahkan dari kimia modern.
Rumusan Masalah
1. Apa aja istilah yang terdapat pada tebel periodik?
2. Ada berapa pengklasifikasian dalam tebel periodik?
3. Bagaimana cara membaca tabel periodik?
Tujuan
1.
Mengetahui beberapa
istilah dalam tebel periodik
2.
Mengetahui klasifikasi
yang ada pada tebel periodik
3.
Memahami cara membaca
tabel periodik
Pembahasan
A. Istilah Dalam Tabel Periodik
1. Periode
Periode merupakan sebutan bagi baris horizontal
yang ada pada tabel periodik. Tabel periodik memiliki 7 periode berdasarkan
tingkat energi atom yang dimiliki.
Perlu diketahui bahwa tidak semua periode
memiliki jumlah unsur yang sama. Periode 1 memiliki jumlah unsur terkecil,
yaitu 2. Sedangkan jumlah unsur terbesar ada pada periode dengan 32 unsur.
2. Golongan
Jika periode merupakan baris horizontal, maka
golongan adalah kolom vertikal pada tabel periodik kimia. Dalam mengklasifikasikan
unsur, golongan memiliki peran yang sangat penting.
Golongan mencakup unsur-unsur dengan susunan
elektron terluar yang sama. Unsur-unsur tersebut memiliki sifat kimia yang sama
karena jumlah elektron terluarnya sama. Golongan ditulis dengan urutan bilangan
romawi.
3. Blok S
Pada tabel periodik kimia, blok s merupakan
unsur dari dua golongan, yaitu logam alkali dan alkali tanah. Blok s juga
mencakup unsur tambahan, yaitu hidrogen dan helium.
4. Blok P
Pada tabel periodik kimia, blok p merupakan
unsur-unsur dari enam golongan. Golongan unsur pada blok p antara lain golongan
3A hingga 8A. S
5. Blok D
Blok d pada tabel periodik terdiri atas 3 hingga
12 golongan mulai dari golongan 3B hingga 2B. Semua unsur kimia pada blok d
merupakan logam transisi.
6. Blok F
Pada tabel periodik, unsur-unsur kimia yang
tergabung di dalam blok f cenderung diletakkan di bagian bawah. Blok f tidak
memiliki nomor golongan dan merupakan unsur lantanida dan aktinida.
B.Klasifikasi Pada Tabel Periodik
1.
Sifat-sifat Umum
Secara umum, unsur- unsur kimia
memiliki sifat fisika dan kimia yang terdiri dari tiga kategori, antara lain
logam, metalloid, dan nonlogam. Berikut ini penjelasan lengkap tentang sifat-
sifat umum pada unsur- unsur kimia:
a.
Logam biasanya berupa padatan yang berkilau
dengan konduktivitas tinggi dan dapat membentuk alloy dengan bentuk logam
lainnya untuk membentuk senyawa ion berupa garam dengan nonlogam atau selain
gas mulia. Berikut ini karakteristik logam pada tabel periodic
1.
78% dari semua unsur yang dikenal
adalah logam
2.
Ditempatkan di sisi kiri tabel
periodik
3.
Biasanya padat pada suhu kamar
4.
Biasanya memiliki titik leleh dan
titik didih yang tinggi
5.
Penghantar panas dan listrik yang baik
6.
Dapat ditempa dan diregangkan
b.
Nonlogam biasanya berbentuk gas berwarna atau
tidak berwarna yang bisa membentuk senyawa dengan bentuk non logam lainnya
secara kovalen. Berikut ini karakteristik nonlogam pada tabel periodik :
1.
Terletak di sisi kanan atas Tabel
Periodik
2.
Total ada 22 non-logam
3.
Biasanya padatan atau gas pada suhu
kamar
4.
Titik leleh dan titik didih rendah
5.
Penghantar panas dan listrik yang
buruk
c.
Metaloid biasanya bersifat di antara logam dan
nonlogam ataupun cempuran dari kedua unsurnya
Klasifikasi pada tabel periodic
biasanya ditunjukan dengan warna tabel yang berbeda- beda. Untuk membatasi
unsur- unsur logam dan nonlogam adalah dengan banyaknya logam dan nonlogam
tersebut dalam unsur kimia. Logam dan nonlogam selanjutnya diklasifikasikan
dalam subkategori dengan gradasi sifat dari logam nonlogam untuk unsur kimia
dalam periode yang sama.
Logam terdiri dari alkali reaktif,
logam alkali tanah kurang reaktif, lantanida aktinida, logam transisi, dan
logam pasca-transisi. Sedangkan non logam terdiri dari poliatomik, non logam
esensial yang merupakan non logam hampir mirip metaloid, dan gas mulia
monoatomic yang merupakan nonlogam hampir inert sempurna. Jika metaloid lebih
menunjukan sifat logam dan nonlogam, seperti silicon, germanium, arsen, dan
antimony.
2.
Keadaan Materi
Hal lain yang juga menjadi pembeda
dalam klasifikasi unsur- unsur kimia adalah wujud materi atau fase unsur
tersebut, seperti cair, padat, atau gas dalam temperatur dan tekanan standar
(STP). Biasanya unsur yang berwujud padat memiliki temperatur konvensional dan
tekanan atmosfer dan beberapa berwujud gas. Sedangkan yang berwujud cair hanya
brom dan raksa pada 0 ◦C atau sekitar 32 ◦F dengan tekanan atmosfer
normal.
3.
Titik Lebur Dan Titik Didih
Titik lebur dan titik didih digunakan
untuk mendefinisikan karakter unsur yang dinyatakan dengan derajat celcius pada
tekanan atmosfer tertentu. Sebenarnya klasifikasi unsur berdasarkan titik lebur
dan titik didih sudah diketahui, namun ada beberapa unsur radioaktif dengan
jumlah sangat kecil belum diketahui. Helium atau He hanya memiliki titik didih
dan tidak memiliki titik lebur pada penyajian konvensional karena tetap berada
pada wujud cair meskipun dalam keadaan nol mutlak pada tekanan
atmosfer.
4.
Massa Jenis
Klasifikasi tabel periodik juga
seringkali menggunakan massa jenis pada temperatur dan tekanan standar (STP)
sebagai karakter unsur kimia. Massa jenis kemudian dinyatakan dalam gram per
sentimeter kubik atau g/cm3. Massa jenis biasanya juga dinyatakan untuk wujud
gas pada temperatur pengukuran wujud tertentu. Misalnya saat dicairkan atau
dipadatkan maka unsur gas memiliki massa jenis yang sama dengan unsur kimia
lainnya.
Saat sebuah unsur kimia memiliki
alotrop dengan massa jenis yang berbeda, maka salah satu alotrop yang
mewakilinya akan dipilih dalam penyajian kesimpulan. Sedangkan massa jenis pada
masing-masing alotrop dapat dijelaskan pada bagian detailnya. Contohnya tiga
alotrop karbon yakni karbon amorf, grafit, intan memiliki massa jenis
masing-masing yaitu 1,8-2,1; 2,267; dan 3,515 g/cm3.
5.
Struktur Kristal
Perlu Grameds ketahui bahwa unsur
kimia yang diteliti sampai saat ini sebagai sampel zat padat memiliki delapan
jenis struktur Kristal dalam materialnya. Yakni kubik, kubik pusat badan, kubus
pusat muka, heksagonal, monokinis, ortorombik, rhombohedral, dan tetragonal.
Pada beberapa unsur transuranium sintetis, sample unsur kimia yang tersedia
sangat sedikit jumlahnya untuk bisa menentukan struktur kristalnya.
6.
Asal Usulnya Di Bumi
Ada 94 unsur pertama yang terbentuk
secara alami , sedengakan ada 24 unsur lainnya yang terbentuk secara artifisial
sebagai produk sintesis lewat reaksi nuklir buatan.
Ada 83 unsur kimia yang dianggap
primordian dan bersifat stabil atau radioaktif yang lemah. 11 unsur sisanya
dianggap sebagai unsur fanal karena memiliki waktu paruh singkat untuk berada
di awal tata surya. 11 unsur tersebut ada 5 unsur polonium, radon, radium,
actinium, dan protactinium.
Unsur tersebut adalah material
peluruhan dari torium dan 6 unsur lainnya adalah unsur fana lainnya yang
diproses dengan reaksi nuklir langka dengan melibatkan titanium atau unsur-
unsur barat. Sisa unsur tersebut adalah teksinium, astatin, promethium,
neptunium, fransium, dan plutonium.
C. Cara Membaca Tabel Periodik
1. Membaca Tabel
Periodik Dari Kiri Atas Ke Kanan Bawah
Tabel unsur- unsur kimia ini
tersusun berdasarkan nomor atom, sehingga semakin ke kanan dan ke bawah, nomor
atom akan semakin besar. Nomor atom pada tabel periodik adalah jumlah
banyaknya proton yang dimiliki atom unsur kimia dan semakin ke kanan nomor
massa atom akan semakin besar. Grameds bisa memahami berat unsur kimia tertentu
meskipun hanya melihat letaknya pada tabel periodik kimia tersebut.
Tabel periodik semakin ke
kanan dan ke bawah menunjukan massa atom unsur kimia yang bertambah karena
dihitung dengan jumlah proton dan neutron disetiap atom unsur kimia tersebut.
Jumlahnya akan terus bertambah karena jumlah protonnya juga bertambah,
sedangkan material elektron tidak berpengaruh banyak terhadap berat atom.
2. Pahami Unsur Kimia
Setiap unsur kimia pasti
mengandung 1 proton lebih banyak daripada atom disebelah kirinya dalam tabel
periodik. Untuk cara mengatasinya Grameds bisa melihat nomor atom yang tersusun
dari kiri ke kanannya.
Unsur-unsur kimia ini
dipisahkan menjadi 3 golongan, misalnya baris pertama menunjukan hidrogen yang
memiliki nomor atom 1, dan helium memiliki nomor atom 2. Maka Grameds bisa
mendefinisikan bahwa kedua unsur tersebut terletak diujung tabel periodik
sebelah kiri dan kanan karena berada pada golongan yang berbeda.
3. Mengenal Golongan
Atom Dengan Sifat Fisik Yang Sama
Golongan tabel periodik
ditampilkan oleh kolom vertikal dan golongan dicirikan dengan beberapa warna
yang sama. Warna ini bisa Grameds gunakan untuk membantu mengidentifikasi
unsur-unsur mana yang memiliki sifat fisik dan kimia yang hampir mirip.
Sehingga akan lebih mudah memprediksi reaksi unsur kimia dari setiap golongan
dengan jumlah elektron yang sama sekalipun.
Seluruh unsur kimia hanya masuk
dalam satu golongan, kecuali hidrogen yang masuk kelompok halogen atau logam
alkali. Unsur kmia hidrogen bahkan muncul di kedua golongan dalam tabel
periodik.
4. Perhatian Ruang
Kosong Pada Tabel
Hal yang juga perlu Grameds
memperhatikan adalah penyusunan unsur-unsur ke dalam kelompok dan golongan
untuk memperkirakan sifat-sifat fisik dan kimia yang sama. Cara ini bisa
memudahkan Grameds memahami setiap unsur yang bereaksi. Jika unsur kimia
bertambah maka penggolongannya juga semakin sulit, itulah alasannya mengapa ada
ruang kosong pada tabel unsur- unsur kimia ini. Misalnya pada 3 baris pertama
tabel memiliki ruang kosong karena berfungsi untuk logam transisi yang akan
dimunculkan di tabel periodik, yaitu nomor atom 21.
5. Perhatian Bahwa
Setiap Baris Disebut Periode
Semua unsur kimia pada satu
periode pasti memiliki jumlah orbital atom yang sama, kemudian akan dilintasi
oleh elektron-elektron tertentu. Jumlah orbital ini akan sesuai dengan jumlah
periode pada tabel periodik dengan menunjukan 7 baris yang artinya adalah 7
periode. Misalnya unsur periode 1 dengan 1 orbital, sedangkan unsur periode 7
juga memiliki 7 orbital. Contoh tersebut diberi nomor 1-7 dari atas ke bawah di
bagian kiri tabel periodik.
6. Bedakan Antara
Logam, Semi Logam, dan Nonlogam
Grameds perlu mengenal jenis
unsurnya agar lebih mudah memahami sifat-sifat unsur pada tabel periodik.
Klasifikasi yang ditunjukan dengan perbedaan warna pada tabel periodik ini
menunjukan apakah unsur tersebut masuk kelompok logam, semi logam, atau
nonlogam. Grameds bisa perhatikan pembedanya untuk menemukan unsur logam di
kanan tabel, sedangkan unsur kimia non logam berada di bagian kiri dan kelompok
semi logam berada di antara logam dan nonlogam.
DAFTAR PUSTAKA
Restu N.Tabel Periodik : Pengertian, Unsur, Klasifikasi, Dan Cara
Membacanya.Gramedia Blog. Diakses pada tanggal 24 september 2023. https://www.gramedia.com/literasi/tabel-periodik/.
Wikipedia.Tabel
Periodik. WikipediA. Diakses pada tanggal 24 september 2023. https://id.wikipedia.org/wiki/Tabel_periodik#:~:text=Tabel%20periodik%20pertama%20yang%20diterima,sifat%20kimia%20pada%20massa%20atom.
Naja Sarjana. Mengenal Tabel Periodik dan Cara
Membacanya.Detik Edu.Diakses pada tanggal 24 september 2023. https://www.detik.com/edu/detikpedia/d-6763430/mengenal-tabel-periodik-dan-cara-membacanya.
Meilani Teniwut. Mengenal Tabel Periodik Unsur Kimia
dan Cara Membacanya.Media Indonesia.Diakses pada tanggal 24 september 2023. https://mediaindonesia.com/humaniora/586191/mengenal-tabel-periodik-unsur-kimia-dan-cara-membacanya.
Silmi Nurul Utami. Tabel
Periodik: Pengertian dan Cara Membacanya.Kompas.com.Diakses pada tanggal
24 september 2023. https://www.kompas.com/skola/read/2022/11/07/143000769/tabel-periodik--pengertian-dan-cara-membacanya?

bagus materinya dan mind mappingnya keren
BalasHapusmaterinya bagus,mudah dipahami
BalasHapusKeren artikelnya penjelasannya mudah dipahami
BalasHapus