
Oleh:Andhika Yudisthira (@J08-Andika)
Lintang Gurun Cahyo (@J09-Lintang)
Muhammad Faishal Abyan (@J10-Faishal)
“Proses suatu sistem terisolasi yang disertai dengan penurunan entropi tidak mungkin terjadi. Dalam setiap proses yang terjadi pada sistem terisolasi, maka entropi sistem tersebut selalu naik atau tetap tidak berubah.” Itulah rumusan hukum kedua dari pada Termodinamika ini.
Hukum kedua termodinamika adalah
ekspresi dari kecenderungan yang dari waktu ke waktu, perbedaan suhu, tekanan, dan menyeimbangkan potensi kimia dalam terisolasi sistem fisik . Dari keadaan kesetimbangan termodinamika , hukum menyimpulkan prinsip peningkatan entropi dan menjelaskan fenomena ireversibilitas di alam. Hukum kedua menyatakan ketidakmungkinan mesin yang menghasilkan energi yang dapat digunakan dari energi internal melimpah alam dengan proses yang disebut gerak abadi dari jenis yang kedua.
Tiga Pernyataan Bagi Hukum Kedua Termodinamika
1.Kalor tidak mengalir secara spontan dari dingin ke panas.
2.Tidak ada mesin yang dapat mengubah kalor menjadi usaha secara utuh,
3.Setiap sistem terisolasi condong menjadi acak.
Hukum II Termodinamika
- Jika tidak ada kerja dari luar, panas tidak dapat merambat secara spontan dari suhu rendah ke suhu tinggi (Clausius)
- Proses perubahan kerja menjadi panas merupakan proses irreversible jika tidak terjadi proses lainnya (Thomson-Kelvin-Planck)
- Suatu mesin tidak mungkin bekerja dengan hanya mengambil energi dari suatu sumber suhu tinggi kemudian membuangnya ke sumber panas tersebut untuk menghasilkan kerja abadi (Ketidakmungkinan mesin abadi)
- Mesin Carnot adalah salah satu mesin reversible yang menghasilkan daya paling ideal. Mesin ideal memiliki efisiensi maksimum yang mungkin dicapai secara teoritis
ENTROPI
Termodinamika menyatakan bahwa proses alami cenderung bergerak menuju ke keadaan ketidakteraturan yang lebih besar. Ukuran ketidakteraturan ini dikenal dengan sistem entropi. Entropi merupakan besaran termodinamika yang menyerupai perubahan setiap keadaan, dari keadaan awal hingga keadaan akhir sistem. Semakin tinggi entropi suatu sistem menunjukkan sistem semakin tidak teratur. Entropi sama seperti halnya tekanan dan temperatur, yang merupakan salah satu sifat dari sifat fisis yang dapat diukur dari sebuah sistem. Apabila sejumlah kalor Q diberikan pada suatu sistem dengan proses reversibel pada suhu konstan, maka besarnya perubahan entropi sistem adalah :
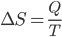
dengan:
ΔS = perubahan entropi ( J/K)
Q = kalor ( J)
T = suhu (K)
MESIN KALOR
Sebuah mesin kalor adalah sesuatu alat yang menggunakan kalor/panas untuk melakukan usaha/kerja.
Mesin kalor memiliki tiga ciri utama:
- Kalor dikirimkan ke mesin pada temperatur yang relatif tinggi dari suatu tempat yang disebut reservoar
- Sebagian dari kalor input digunakan untuk melakukan kerja oleh working substance dari mesin, yaitu material dalam mesin yang secara aktual melakukan kerja (e.g., campuran bensin-udara dalam mesin mobil).
- Sisa dari kalor input heat dibuang pada temperatur yang lebih rendah dari temperatur input ke suatu tempat yang disebut reservoar
Skema Mesin Kalor
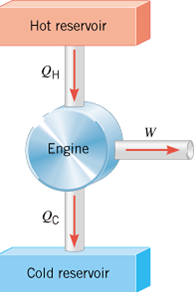
Gambar ini melukiskan skema mesin kalor :
- QH menyatakan besarnya input kalor, dan subscript H menyatakan hot reservoir.
- QC menyatakan besarnya kalor yang dibuang, dan subscript C merepresentasikan cold reservoir.
- W merepresentasikan kerja yang dilakukan.
CONTOH SOAL
- 1,5 m3 gas helium yang bersuhu 27oC dipanaskan secara isobarik sampai 87oC. Jika tekanan gas helium 2 x 105 N/m2 , gas helium melakukan usaha luar sebesar….A. 60 kJB. 120 kJC. 280 kJD. 480 kJE. 660 kJ
Pembahasan
Data :
V1 = 1,5 m3
T1 = 27oC = 300 K
T2 = 87oC = 360 K
P = 2 x 105 N/m2
W = PΔV
Mencari V2 :
V2/T2 = V1/T1
V2 = ( V1/T1 ) x T2 = ( 1,5/300 ) x 360 = 1,8 m3
W = PΔV = 2 x 105(1,8 − 1,5) = 0,6 x 105 = 60 x 103 = 60 kJ (A)
Mencari V2 :
V2/T2 = V1/T1
V2 = ( V1/T1 ) x T2 = ( 1,5/300 ) x 360 = 1,8 m3
W = PΔV = 2 x 105(1,8 − 1,5) = 0,6 x 105 = 60 x 103 = 60 kJ (A)
- Diagram P−V dari gas helium yang mengalami proses termodinamika ditunjukkan seperti gambar berikut!
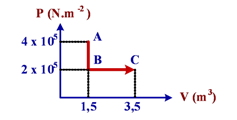
Usaha yang dilakukan gas helium pada proses ABC sebesar….
A. 660 kJ
B. 400 kJ
C. 280 kJ
D. 120 kJ
E. 60 kJ
Pembahasan
WAC = WAB + WBC
WAC = 0 + (2 x 105)(3,5 − 1,5) = 4 x 105 = 400 kJ (B)
DAFTAR PUSTAKA:
Oktetkimiaacgcmail 2017. Hukum II Termodinamika. dalam https://oktetkimiacgmail.wordpress.com/2017/12/10/hukum-ii-termodinamika/
Alfurqan,m 2012. pengertian Termodinamika II. dalam https://furqanlawera.blogspot.com/2012/12/hukum-ii-termodinamika.html
Darmawan,alfiansyah 2017. mesin kalor, entropi, hukum kedua termodinamika. dalam https://physicsranggaagung.wordpress.com/2017/06/26/mesin-kalor-entropi-dan-hukum-kedua-termodinamika/
@J05-Alif,@J07-Adhytia
BalasHapusSoal :
Mengapa pada skema mesin kalor terdapat dua jenis reservoir? tolong jelaskan lebih lanjut
Karna kalor mengalir secara alami dari benda yang panas ke benda yang dingin, kalor tidak akan mengalir secara spontan dari benda dingin ke benda panas
BalasHapus