Oleh : @Kel-K06, @K17-Natalia, @K19-Luthfiah
Termodinamika adalah ilmu yang mempelajari hubungan antara
usaha dan kalor. Di dalam termodinamika dikenal dengan adanya sistem dan
lingkungan. Dalam termodinamika sistem diarttikan sebagai kumpulan dari benda –
benda atau objek yang diteliti atau menjadi pusat perhatian kita sedangkan
lingkungan diartikan sebagai benda atau objek yang berada di luar sistem.
Pernyataan paling umum dari hukum
pertama termodinamika ini berbunyi:
“Kenaikan energi internal dari suatu sistem
termodinamika sebanding dengan jumlah energi panas yang ditambahkan ke dalam
sistem dikurangi dengan kerja yang dilakukan oleh sistem terhadap
lingkungannya.”
Hukum
Pertama Termodinamika melibatkan tiga variabel yaitu kalor, usaha dan perubahan
energi dalam. Terdapat dua jenis proses dalam sistem termodinamika , yaitu
kalor dan usaha diberikan pada sistem atau dihasilkan oleh sistem.
Secara matematis, Hukum Pertama Termodinamika
dituliskan sebagai berikut.
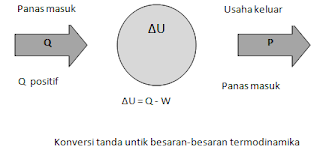
Q = ΔU + W
Q = kalor yang diterima atau dilepaskan oleh
sistem (J)
ΔU = U2 — U1 =
perubahan energi dalam sistem (J)
W = usaha yang dilakukan sistem (J)
Perjanjian tanda yang berlaku untuk persamaan di atas tersebut
adalah sebagai berikut.
1. Jika sistem melakukan kerja maka nilai W
berharga positif.
2. Jika sistem menerima kerja maka nilai W
berharga negatif
3. Jika sistem melepas kalor maka nilai Q
berharga negatif
4. Jika sistem menerima kalor maka nilai Q
berharga positif
 |
| Sumber : 3.bp.blogspot.com |
Termokimia
Termokimia merupakan ilmu kimia yang
mempelajari perubahan kalor atau panas suatu zat yang menyertai suatu reaksi
atau proses kimia dan fisika. Termokimia mempelajari hubungan antara energi
panas dan energi kimia. Energi potensial kimia yang trkandung dalam suatu zat
disebut panas dalam atau entalpi dan dinyatakan dengan
simbol H. Selisih antara entalpi reaktan dan entalpi hasil pada
suatu reaksi disebut perubahan entalpi reaksi, dan diberi simbol ΔH.
Reaksi pada termokimia terbagi atas :
1. Reaksi Eksoterm
(-)
Reaksi yang terjadi saat berlangsungnya
pelepasan panas atau kalor.
2. Reaksi Endoterm
(+)
Reaksi yang terjadi ketika berlangsungnya
penyerapan panas atau kalor.
Jenis Perubahan Entalpi
1. Perubahan entalpi pembentukan (ΔHf)
Merupakan perubahan entalpi pembentukan 1 mol
senyawa dari unsur-unsur penyusunnya pada keadaan standar.
2. Perubahan entalpi penguraian (ΔHd)
Adalah ΔH untuk menguraikan 1 mol suatu
senyawa menjadi unsur-unsur penyusunnya pada keadaan standar
3. Perubahan entalpi pembakaran (ΔHc)
Adalah ΔH dalam pembakaran sempurna 1 mol
suatu senyawa pada keadaan standar.
4. Perubahan entalpi netralisasi (ΔHn)
Termasuk reaksi eksoterm. Adalah kalor yang
dilepas pada pembentukan 1 mol air dan reaksi asam-basa pada suhu 25 derjat
celsius dan tekanan 1 atmosfer.
Penentuan Entalpi Reaksi
1. Penentuan dengan kalorimetri
Dengan mengukur perubahan suhu, kita dapat
menentukan jumlah energi kalor reaksi berdasarkan rumus:
Ql
= m.c. Δt Qk = C. Δt
Ql =
energi kalor pada larutan (J)
m
= massa zat (kg)
c
= kalor jenis zat (J/kg°C)
C
= kapasitas kalor (J/°C)
Δt
= perubahan suhu (°C)
Karena kalorimeter merupakan sistem
terisolasi, maka tidak ada energi yang terbuang ke lingkungan, sehingga mlah
energi kalor reaksi dan perubahan entalpi reaksi menjadi:
Qreaksi
= Ql +Qk ΔH = -Qreaksi/jumlah mol
2. Penentuan dengan data energi ikatan
Energi ikatan (E) adalah energi yang dibutuhkan
untuk memutuskan 1 mol ikatan kovalen dari suatu senyawa, setiap ikatan
membutuhkan energi yang berbeda agar dapat terputus.
Reaksi berlangsung dalam dua tahap:
1) Pemutusan ikatan reaktan
2) Pembentukan ikatan produk
Hukum
yang terkait :
1. Hukum Laplace
Hukum ini dikemukakan
oleh Marquis de Laplace (1749-1827), yang berbunyi :
“Jumlah kalor yang dilepaskan pada
pembentukan suatu senyawa dari unsur-unsurnya sama dengan jumlah kalor yang
diperlukan untuk menguraikan senyawa itu menjadi unsure-unsurnya.
2. Hukum Hess
Hukum ini dikemukakan
oleh German Hess (1840), yang berbunyi :
“Bila suatu perubahan kimia dapat
dibuat menjadi beberapa jalan/cara berbeda, jumlah perubahan energy panas
keseluruhannya (total) adalah tetap, tidak bergantung pada jalan/cara yang
ditempuh.”
Contoh Soal
1. Diketahui
:
H2 + F2 → 2HF dH = -537 kj
C + 2F2 → CF4 dH = -680 kj
2C + 2H2 → C2H4 dH = 52,3 kj
Maka tentukanlah dH reaksi berikut !
C2H4 + 6F2 → 2CF4 + 4HF
→ Untuk menjawab soal di atas, kita harus menggunakan
prinsip hokum hess. Berikut ini penjelasanya :
2. Diketahui :
dHf C2H8 = -150 kj
dHf CO2 = -393,5 kj
dHf H2O = -242 kj
Reaksi pembakaran etana adalah :
2C2H6 + 7O2 → 4CO2 + 6H2O
Berapakah harga dH reaksi pembakaran 2 mol gas
etana di atas ?
→ Untuk menjawab soal di atas, kita harus melakukan
langkah-langkah berikut :
Daftar Pustaka
- Suryantari, Risti. 2013. Tinjauan Terhadap Formulasi Hukum Pertama Termodinamika, [online], (http://download.garuda.ristekdikti.go.id/article.php?article=160664&val=4509&title=Problem%20Solving%20dengan%20Metode%20Identifikasi%20Variabel%20berdasarkan%20Skema:%20Tinjauan%20terhadap%20Formulasi%20Hukum%20Pertama%20Termodinamika, diakses tanggal 29 September 2018)
- Wikipedia. 2006. Hukum Pertama Termodinamika, [online], (https://id.wikipedia.org/wiki/Hukum_pertama_termodinamika, diakses tanggal 29 September 2018)
- Anonim. 2015. Hukum I Termodinamika dan Penerapannya, [online], (http://fiskadiana.blogspot.com/2015/04/hukum-i-termodinamika-dan-penerapannya.html, diakses tanggal 29 September 2018)
- Anonim. 2015. Hukum I Termodinamika, [online], (http://www.informasi-pendidikan.com/2015/02/hukum-i-termodinamika.html, diakses tanggal 29 September 2018)
- Anonim. 2015. Contoh Soal dan Pembahasan Termokimia, [online], (http://www.panduankimia.net/2017/05/contoh-soal-termokimia-50-contoh-soal.html?m=1, diakses tanggal 30 September 2018)




@K13-Eggy, @K15-Rivaldi
BalasHapusSoal:
Proses apa yang terjadi pada perubahan entalpi dalam kehidupan sehari - hari ?
@K17-Natalia @K19-Luthfiah @Kel-K06
HapusPada dasarnya, perubahan entalpi biasa digunakan dalam praktek di laboratorium kimia atau kimia industri.
Namun ada contoh yang bisa diamati dalam kehidupan sehari-hari yaitu beberapa reaksi kimia yang menyebabkan perubahan suhu. Perubahan suhu berarti ada perubahan energi kalor. Misalnya pada pencampuran air dengan kapur yang menyebabkan air jadi hangat, berarti reaksi itu mengeluarkan (kebalikan dari menyerap) energi.
Terima kasih atas pertanyaannya, semoga bermanfaat!