Oleh : Aziz Affandi (@V04-Aziz)
Pengertian Termodinamika
Usaha sistem terhadap lingkungan
Perubahan energi dalam
Hukum Termodinamika
Hukum I Termodinamika
Hukum I termodinamika menyatakan
bahwa jumlah kalor pada suatu sistem sama dengan perubahan energi dalam sistem
ditambah usaha yang dilakukan oleh sistem.
Q = ∆U + W
Perjanjian tanda untuk Q dan W sebagai berikut :
1. Jika
sistem melakukan usaha terhadap lingkungan maka W bertanda
positif.
2. Jika sistem menerima usaha dari lingkungan maka W bertanda negatif.
3. Q bertanda positif jika sistem menerima kalor dari lingkungan
4. Q bertanda negatif
jika sistem memberikan kalor kepada lingkungan
Proses Termodinamika
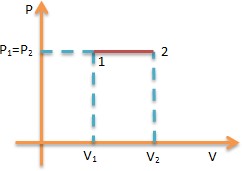
Proses Isokhorik
yaitu proses termodinamika yang terjadi pada gas dalam
keadaan volum tetap.
Berlaku:
Usaha W= 0 maka Q = ΔU
sehingga Q = 3/2 nRT (T2-T1)
berlaku persamaan.
Usaha W
W=P(V2 - V1)
Perubahan energi dalam ΔU
ΔU= 3/2 P(V2 -V1)
Sehingga
Q= 5/2 P(V2-V1)
Proses Isotermik
merupakan proses termodinamika yang terjadi pada gas keadaan suhu tetap.
berlaku persamaan.
Usaha W
Perubahan energi
dalam ΔU = 0 maka
kalor Q = W
Proses Adiabatik
merupakan proses termodinamika yang berlangsung tanpa adanya pertukaran kalor antara sistem dan lingkungan.
berlaku persamaan.
Usaha W
Karena Q = 0 sehingga
ΔU = -W
y = konstanta Laplace
Kapasitas Kalor
Merupakan banyaknya kalor yang dibutuhkan untuk menaikan suhu gas sebesar 1oC, dinyatakan dengan persamaan:
Kapasitas kalor gas dapat dibedakan menjadi dua yaitu kapasitas kalor pada tekanan tetap (Cp) dan pada volume tetap (Cv)
Pada proses isokhorik
Qv = ∆U
Pada proses isobarik
Qp = ∆U + p∆V
Diperoleh:
Pengaplikasian Termodinamika
Mesin Carnot
Sebuah mesin Carnot memiliki empat langkah dalam pengoprasiannya. Berikut urutan keempat langkah proses yang terjadi dalam siklus Carnot.
- Pada langkah pertama, gas mengalami ekspansi isotermal. Reservoir suhu tinggi menyentuh dasar silinder dan jumlah beban di atas piston dikurangi. Selama proses ini berlangsung, temperatur sistem tidak berubah, namun volume sistem bertambah. Dari keadaan 1 ke keadaan 2, sejumlah kalor (Q1) dipindahkan dari reservoir suhu tinggi ke dalam gas.
- Pada langkah kedua, gas berubah dari keadaan 2 ke keadaan 3 dan mengalami proses ekspansi adiabatik. Selama proses ini berlangsung, tidak ada kalor yang keluar atau masuk ke dalam sistem. Tekanan gas diturunkan dengan cara mengurangi beban yang ada di atas piston. Akibatnya, temperatur sistem akan turun dan volumenya bertambah.
- Pada langkah ketiga, keadaan gas berubah dari keadaan 3 ke keadaan 4 melalui proses kompresi isotermal. Pada langkah ini, reservoir suhu rendah (200 K) menyentuh dasar silinder dan jumlah beban di atas piston bertambah. Akibatnya tekanan sistem meningkat, temperaturnya konstan, dan volume sistem menurun. Dari keadaan 3 ke keadaan 4, sejumlah kalor (Q2) dipindahkan dari gas ke reservoir suhu rendah untuk menjaga temperatur sistem agar tidak berubah.
- Pada langkah keempat, gas mengalami proses kompresi adiabatik dan keadaannya berubah dari keadaan 4 ke keadaan1. Jumlah beban di atas piston bertambah. Selama proses ini berlangsung, tidak ada kalor yang keluar atau masuk ke dalam sistem, tekanan sistem meningkat, dan volumenya berkurang.
Mesin Carnot adalah mesin efisien
yang bekerja dalam suhu reservoir tinggi dan
suhu reservoir rendah. Oleh karena itu, suatu mesin Carnot memiliki
efisiensi. Rumus efisiensi mesin Carnot sebagai berikut.
keterangan:
ŋ = efisiensi mesin kalor
T2 = suhu pada reservoir rendah (K)
T1
= suhu pada reservior tinggi (K)
W = usaha (Joule)
Q1= kalor yang diserap (Joule)
Q2 = kalor yang dilepas (Joule)
Mesin
Pendingin
Prinsip kerja mesin pendingin
contohnya lemari es dan penyejuk ruangan yaitu mengalirkan kalor keluar dari
lingkungan sejuk ke lingkungan hangat. Sistem menerima kerja sebesar W dan menyerap
kalor dengan suhu reservoir rendah T2 sebesar Q2 serta membuang sejumlah kalor yang lebih
besar ke reservoir suhu tinggi T1
sebesar Q1. Untuk
kerja dari mesin pendingin dapat ditentukan melalui koefisiensi performansi Kp.
Keterangan :
Kp = koefisiensi performansi
T2 = suhu pada reservoir rendah (K)
T1 = suhu pada reservior tinggi (K)
W = usaha (Joule)
Q1= kalor yang diserap (Joule)
Q2 = kalor yang dilepas
(Joule)
SUMBER REFERENSI
Hamid,
A. A. (2007). Kalor dan termodinamika. Universitas Negeri Yogyakarta.
Haryanto,
A. (2016). Termodinamika.
Soekardi,
C. (2015). Termodinamka Dasar Mesin Konversi Energi. Penerbit Andi.









Tidak ada komentar:
Posting Komentar
Catatan: Hanya anggota dari blog ini yang dapat mengirim komentar.