Kesetimbangan Kimia :
Tetapan Kesetimbangan Kimia
Oleh
: Cecep Syaripudin (@v09-cecep)
Semua benda yang diam dan tidak bergerak dapat
dikatakan selalu ada di dalam keadaan setimbang. Prinsip kesetimbangan dalam reaksi kimia,
pertama kali dikemukakan oleh Berthollt sewaktu menjadi penasehat ilmiah
Napoleon di Mesir, sedangkan kajian secara laboratorium dilakukan oleh Guldberg
dan Waage. Mereka menunjukkan bahwa reaksi kesetimbangan dapat didekati dalam
dua arah, dan mereka berhasil menunjukkan hubungan matematis antara konsentrasi
pereaksi dan produk dalam kesetimbangan. Pada kesempatan lain, van't Hoff
mengusulkan persamaan matematis untuk kesetimbangan dinamis, yakni konsentrasi
pereaksi merupakan pangkat dari koefisien reaksinya.
Pada
reaksi yang berlangsung bolak balik, ada saat dimana laju terbentuknya produk
sama dengan laju terurainya produk menjadi reaktan. Pada keadaan ini, biasanya
tidak terlihat lagi ada perubahan. Keadaan reaksi dengan laju reaksi kekanan
(maju) sama dengan laju reaksi sebaliknya (ke kiri) dinamakan keadaan
setimbang.
Kesetimbangan
kimia adalah keadaan saat kedua
reaktan dan produk hadir dalam konsentrasi yang tidak memiliki kecenderungan
lebih lanjut untuk berubah seiring berjalannya waktu.
Ciri-ciri kesetimbangan kimia :
- Terjadi pada reaksi reversible (reaksi yang dapat berjalan dua arah atau bolak balik).
- Bersifat dinamis
- Reaksi seolah berhenti, tetapi secara molekuler reaksi terus terjadi.
- Reaksi mencapai kesetimbangan ketika laju reaksi ke kanan sama dengan laju reaksi ke kiri (v1=v2), sehingga perbandingan konsentrasi reaktan dan produk itu tetap.
Kesetimbangan kimia terdiri atas dua macam, yaitu kesetimbangan
statis dan kesetimbangan
dinamis. Kesetimbangan statis terjadi jika reaksi kimia yang
dihasilkan merupakan reaksi kimia satu
arah atau reaksi kimia yang tidak dapat kembali lagi seperti semula. Sedangkan kesetimbangan
dinamis terjadi jika reaksi kimia yang dihasilkan merupakan reaksi kimia dua arah atau reaksi kimia
yang bisa kembali lagi seperti
semula.
Ketika kamu membakar selembar kertas, abu yang dihasilkan tidak dapat berubah
menjadi kertas lagi. Hal ini termasuk contoh kesetimbangan statis. Akan
tetapi, walau sama-sama menghasilkan reaksi, air yang direbus hingga menghasilkan
uap akan memberi reaksi yang berbeda dengan kertas yang dibakar menjadi abu.
Mengapa? Sebab, jika uap terkena
tutup panci atau benda lainnya maka akan berubah kembali menjadi air. Nah,
hal ini disebut dengan kesetimbangan dinamis karena ada perubahan dua
arah.
A. Kesetimbangan Dinamis
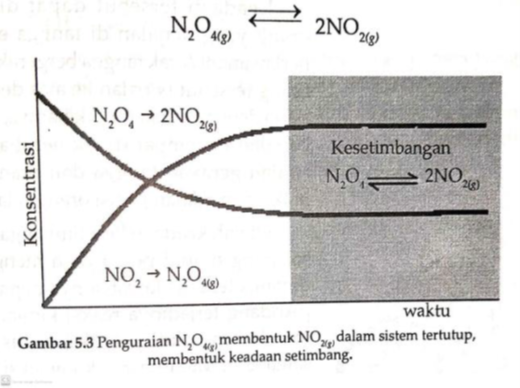
Untuk memahami keadaan kesetimbangan dalam sistem kimia, tinjau reaksi disosiasi dinitrogen tetroksida dalam sistem tertutup dengan cara pemanasan. Persamaan reaksinya :
Pada saat yang sama, molekul-molekul NO2 hasil reaksi terasosiasi kembali membentuk N2O4, dan lajunya proporsional
dengan konsentrasi NO2 yang terbentuk. Oleh karena konsentrasi NO2 pada awalnya
sangat kecil, maka laju penguraian N2O4 membentuk NO2 lebih cepat dari pada laju
asosiasi NO2 membentuk N2O4.
N2O4(g) ß NO2(g)
Oleh karena laju penguraian gas N2O4 lebih
cepat daripada asosiasi gas NO2, maka konsentrasi NO2 yang terbentuk makin
meningkat sejalan dengan waktu, yang pada akhirnya konsentrasi masing-masing
gas dalam sistem reaksi tidak berubah dan laju pada kedua arah reaksi sama.
Pada keadaan ini dikatakan sistem telah mencapai keadaan kesetimbangan, seperti
ditunjukkan pada Gambar 5.3. Reaksi kimia dalam keadaan kesetimbangan
dituliskan dalam bentuk persamaan berikut.
Dalam kesetimbangan, suatu keadaan mantap
dicapai secara kinetik, artinya laju pereaksi'membentuk produk sama dengan laju
produk menjadi pereaksi. Pada keadaan itu, reaksi yang menuju produk dan reaksi
yang menuju pereaksi berlangsung secara bersamaan dengan kecepatan yang sama
sehingga konsentrasi masing-masing zat tidak berubah terhadap waktu. Keadaan
reaksi ini diidentifikasi sebagai kesetimbangan dinamis, seperti ditunjukkan
pada Gambar 5.4.
B.
Tetapan Kesetimbangan Kimia ,
Tetapan kesetimbangan dibagi menjadi 2 (dua) yaitu tetapan
kesetimbangan konsentrasi atau Kc, dan tetapan kesetimbangan tekanan parsial
atau Kp.
Tetapan
Kesetimbangan Konsentrasi (Kc)
Secara matematis, tetapan
kesetimbangan konsentrasi atau Kc adalah perbandingan hasil kali konsentrasi
dari produk yang dipangkatkan koefisiennya dengan hasil kali konsentrasi dari
reaktannya yang dipangkatkan koefisiennya. Tetapan yang satu ini dibagi lagi
menjadi 2 (dua), yaitu:
1.
Kesetimbangan Homogen
Sesuai dengan namanya yang
mengandung kata “homogen”, kesetimbangan ini merupakan jenis kesetimbangan yang
terjadi pada saat produk dan juga reaktan nya berasal dari fase yang sama,
yaitu seluruhnya gas (g) atau seluruhnya cairan (aq), seperti dibawah ini.
aA(g) + bB(g) ⇄ cC(g) + dD(g)
(Reaktan) (Produk)
Maka, nilai kesetimbangan konsentrasinya disusun sebagai berikut :
Kc = tetapan
kesetimbangan
A = Molaritas zat A (M)
B = Molaritas zat B (M)
C = Molaritas zat C (M)
D = Molaritas zat D (M)
2. Kesetimbangan Heterogen
Banyak reaksi-reaksi kimia yang membentuk
kesetimbangan berada dalam fase yang tidak homogen, dimana terdapat dua atau
lebih fase hadir bersamasama dalam satu sistem kesetimbangan. kesetimbangan heterogen merupakan
jenis kesetimbangan yang terjadi pada saat produk dan reaktan memiliki fase
yang berbeda. Di mana yang hanya mempengaruhi tetapan kesetimbangan hanya unsur
yang berwujud gas (g) dan cairan (aq). Misalnya sebagai berikut:
aA(aq)
+ bB(s) ⇄ cC(s) + dD(g)
(Reaktan) (Produk)
Maka,
nilai kesetimbangan disusun sebagai berikut :
Di
mana,
Kc =
tetapan kesetimbangan
A =
Molaritas zat A (M)
D =
Molaritas zat D (M)
Tetapan Kesetimbangan Tekanan Parsial (Kp)
Berbeda
dengan kesetimbangan konsentrasi atau Kc, pada tetapan kesetimbangan kimia
tekanan parsial atau Kp hanya fase dalam wujud gas yang diperhitungkan
mempengaruhi tetapan keseimbangannya.
Untuk menentukan tekanan parsial suatu zat dari tekanan parsial totalnya digunakan persamaan sebagai berikut :
Kenapa
diperlukan nilai P suatu zat ? Karena akan digunakan untuk mencari Kp-nya.
Sama
halnya dengan tetapan kesetimbangan konsentrasi, tetapan kesetimbangan tekanan
parsial juga dibagi menjadi 2 (dua) yaitu reaksi homogen dan heterogen. Dengan
susunan persamaan sebagai berikut:
Reaksi
Homogen
Reaksi
Heterogen
Karena
reaksi heterogen hanya memperhitungkan fase berwujud gas (g) yang mempengaruhi
tetapan kesetimbangan, maka susunan Kp terhadap reaksi heterogen adalah sebagai
berikut:
Hubungan Kc dan Kp
Lalu,
apa hubungan antara Kc dan Kp? Secara matematis, hubungan keduanya tersusun
sebagai berikut :
Di
mana,
R =
konstanta 0,082 L atm/mol K
T =
suhu Kelvin (K)
∆n
= Ʃkoefisien produk – Ʃkoefisien reaktan
C. Manipulasi Tetapan Kesetimbangan
Pada kajian termokimia, persamaan termokimia
dapat dimanipulasi melalui penjumlahan, pembalikan arah, atau perkalian
koefisien reaksi dengan bilangan tertentu, operasi ini dapat mempengaruhi harga
perubahan entalpi. Serupa dengan itu, kesetimbangan kimia dapat dimanipulasi
yang mempengaruhi tetapan kesetimbangan, tetapi aturan mainnya berbeda.
a. Penggabungan Persamaan Kesetimbangan
Jika dua atau lebih persamaan kimia yang
mengandung unsur-unsur yang sama dalam keadaan kesetimbangan digabungkan, maka
tetapan kesetimbangan hasil penggabungan merupakan perkalian dari tetapan
kesetimbangan yang digabungkan, seperti ditunjukkan pada contoh berikut :
Penjumlahan kedua persamaan kimia tersebut
menghasilkan tetapan kesetimbangan yang nilainya sama dengan pekalian kedua
tetapan kesetimbangan yang digabungkan : K3 = K1 x K2.
b. Pembalikan Arah Reaksi Kesetimbangan
Jika penulisan persamaan reaksi dalam kesetimbangan dibalikan, maka harga tetapan kesetimbangan baru merupakan kebalikan dari tetapan semula. Misalnya, persamaan kesetimbangan berikut :
Kebalikan dari persamaan tersebut adalah :
Ungkapan tetapan kesetimbangan untuk
persamaan reaksi (a) dan reaksi (b) menghasilkan kesimpulan bahwa tetapan
kesetimbangan persamaan (b) sama dengan kebalikan dari persamaan (a), atau
Kc=1Kc
Pergeseran kesetimbangan adalah
perubahan dari keadaan kesetimbangan semula ke keadaan kesetimbangan yang baru
akibat adanya aksi atau pengaruh dari luar. Henry Louis Le Chatelier, ahli
kimia Prancis (1852-1911) mengemukakan suatu pernyataan mengenai perubahan yang
terjadi pada sistem kesetimbangan jika ada pengaruh dari luar. Pernyataan ini
dikenal sebagai Azas Le Chatelier, yang berbunyi “Jika suatu sistem
kesetimbangan menerima suatu aksi, maka sistem tersebut akan mengadakan reaksi
sehingga pengaruh aksi menjadi sekecil-kecilnya.”
DAFTAR
PUSTAKA
Modul
Kimia dan Pengetahuan Lingkungan Industri, Universitas mercu Buana. Jakarta Atep
Afia Hidayat, Ir.MP. Kimia dan Pengetahuan Lingkungan Industri. 2021.
Jakarta.
https://www.ruangguru.com/blog/kesetimbangan-kimia-jenis-jenis-reaksi-dan-tetapan
https://www.zenius.net/blog/materi-kesetimbangan-kimia








Tidak ada komentar:
Posting Komentar
Catatan: Hanya anggota dari blog ini yang dapat mengirim komentar.