Oleh: Ika Devi Mayang Sari (@T03-Ika)
 |
| Peta Pikiran Struktur Atom dan Unsur Periodik |
Ilmu kimia mempelajari tentang materi dan perubahan yang terjadi di dalamnya. Pengetahuan yang mendalam tentang konsep-konsep kimia sangat penting dalam pembelajaran kimia. Salah satu konsep yang dipelajari adalah materi perkembangan model atom, terutama Teori Atom Kuantum dan Teori Bohr. Perkembangan model atom merupakan materi yang bersifat abstrak dan hafalan, sehingga sulit untuk dimengerti. Dengan penulisan artikel ini, diharapkan dapat memudahkan pemahaman konsep tentang atom untuk setiap orang yang ingin mempelajarinya.
Kata kunci: kimia, ilmu, model atom, teori, kuantum, Bohr, Dalton, , patikel, elektron, proton, neutron
Abstract
Chemistry is the study of matter and the changes that occur in it. Depth knowledge of chemistry concepts are very important in learning chemistry. One of the concepts being studied is the material development of the atomic model, especially Atomic Theory and the Quantum Theory of Bohr. The development of the atomic model is an abstract and rote material, making it difficult to understand. By writing this article, is expected to facilitate the understanding of the concept of the atom for every person who wants to learn it.
Keywords: chemistry, science, atomic model, theory, quantum, Bohr, Dalton, , particle, electron, proton, neutron
1. Pendahuluan
Ilmu terus berkembang sesuai dengan perkembangan pengetahuan dan teknologi. Perkembangan ilmu terlihat dari terjadi pergantian ide ataupun gagasan ilmiah. Filsuf dan sejarawan sains menginterpretasikan perkembangan gagasan dalam sains dengan dua cara yaitu evolusi dan revolusi. Menurut karl popper perkembangan sains bersifat evolusi yang dicapai melalui falsifikasi teori-teori yang tidak benar, sehingga teori baru yang muncul semakin dekat dengan kebenaran. Teori-teori yang baru mengandung teori-teori yang lama. (Firman, H. 2015, Sofia, 2017)
2. Rumusan Masalah
Ø Apa saja partikel-partikel dasar penyusun atom?
Ø Bagaimana teori kuantum dan model atom Bohr ditemukan?
Ø Siapa yang berperan penting dalam penyusunan sistem periodik unsur?
3. Tujuan
Ø Untuk mengetahui apa partikel-partikel dasar penyusun atom
Ø Untuk mengetahui bagaimana teori kuantum dan model atom Bohr ditemukan
Ø Untuk mengetahuai siapa yang berperan penting dalam penyusunan sistem periodik unsur
4. Pembahasan
Seorang filsafat Yunani, Demokritus, ia adalah orang pertama yang megusulkan sebutan “Atom” ini. Kata atom berasal dari suku kata a yang berati “tidak” dan tomos yang berati “dibagi”, sehingga atom merupakan bagian terkecil dari materi yang tidak dapat dibagi-bagi lagi.
Sebelumnya partikel atom ditemukan, atom dianggap seperti layaknya sebuah bola pejal yang utuh, menurut Teori Dalton. Kemudian setelahnya ada penemuan bahwa atom ternyata memiliki partikel patikem penyusunya lagi didalamnya yaitu elektron yang bermuatan negatif (-), yang letaknya digambarkan layaknya roti kismis, menurut Teori Thomson. Lalu di dalam atom ternyata memiliki sebuah ini atom yang bermuatan positif. Namun ternyata di dalam inti atom tersebut tidak hanya partikel positif saja, tetapi ada juga partikel yang tidak bermuatan atau netral yang dikenal dengan sebutan neutron. Dan untuk partikel positif yang ada di inti atom disebut proton (+).
 |
| ekimia.web.id |
Teori kuantum yang dikemukakan Max Planck (1900) menyatakan, bahwa energi suatu materi hanya dapat berubah (bertambah atau berkurang) dengan suatu kelipatan satuan energi yang disebut kuantum. Jadi menurut teori ini energi suatu materi hanya dapat berubah dengan 1, 2, 3, ... n kuanta dan tak mungkin dengan, misalnya 11/2, 31/2 atau 175,4 kuanta. Energi satu kuantum tidak tetap, melainkan bergantung pada frekuensi radiasi yang karena dipancarkan atau diabsorpsi menyebabkan perubahan energi. Hubungan ini dinyatakan dalam persamaan :
E = h . n ;
di mana E adalah energi kuantum, h ialah tetapan Planck (= 6,625 X 10-27 erg.detik) dan n menunjukkan frekuensi dari radiasi.
Oleh karena frekuensi n dan panjang gelombang 𝜆 suatu radiasi dihubungkan dengan persamaan: n = c/𝜆, maka persamaan tersebut dapat dituliskan: E = h.c/𝜆. Kesimpulan ini dirumuskan Planck berdasarkan kenyataan bahwa benda yang bergetar mengalami perubahan energi dengan cara pemancaran atau absorpsi radiasi dengan frekuensi yang sama dengan frekuensi benda yang bergetar. Albert Einstein (1905) kemudian menunjukkan bahwa persamaan Planck tersebut dapat dirumuskan secara lebih umum. Menurut Einstein, bila energi suatu benda berubah dari harga E1 menjadi harga E2, dengan cara pemancaran atau absorpsi radiasi dengan frekuensi n, maka: E1 – E2 = n h n = n h c/𝜆 ; dengan n ialah bilangan bulat 1,2,3,.... (Keenan, 1980; Petrucci, 1985 dalam Farida, 2009)
Teori atom Bohr yang dikemukakan oleh Niels Bohr (1885-1962) pada tahun 1913 menyusun model atom hidrogen berdasarkan teori atom Rutherford dan teori kuantum Planck, dengan dua postulat yang sangat fundamental, yaitu sebagai berikut.
Postulat 1: Elektron dapat mengelilingi inti menurut lintasan berupa lingkaran tertentu tanpa memancarkan radiasi elektromagnetis. Lintasan berupa lingkaran tertentu ini mempunyai momentum anguler merupakan kelipatan bilangan bulat dari panjang gelombang de Broglie atau 2𝜋r = n 𝜆 de Broglie.
Postulat 2: Tiap-tiap lintasan elektron mempunyai tingkat energi sendiri-sendiri. Apabila elektron meloncat dari suatu lintasan yang tingkat energinya En ke lintasan yang tingkat energinya E1 maka akan dipancarkan energi foton yang besarnya sama dengan hf.
Tingkat energi ini semuanya negatif, hal ini menyatakan bahwa elektron tidak memiliki energi yang cukup untuk melepaskan diri dari inti atom. Tingkat energi yang terendah E1 disebut keadaan dasar dari atom itu dan tingkat energi lebih tinggi E2, E3, E4,.... disebut keadaan eksitasi (status eksitasi). Ketika bilangan kuantum n bertambah, energi En yang bersesuaian menjadi nol, dalam limit n=∞. E∞= 0 dan elektronnya tidak lagi terikat pada inti untuk membentuk atom.
Energi positif untuk kombinasi inti elektron berarti bahwa elektronnya tidak terikat pada inti dan tidak syarat kuantum yang harus dipenuhinya; kombinasi seperti itu tidak membentuk atom. Energi yang dibutuhkan untuk membebaskan elektron dari atom dalam keadaan dasarnya disebut energi ionisasi. Energi ionisasi atom hidrogen biasanya -13.6 eV sama dengan –E1. (Arief dkk, 2014)
 |
| gifmaker.me |
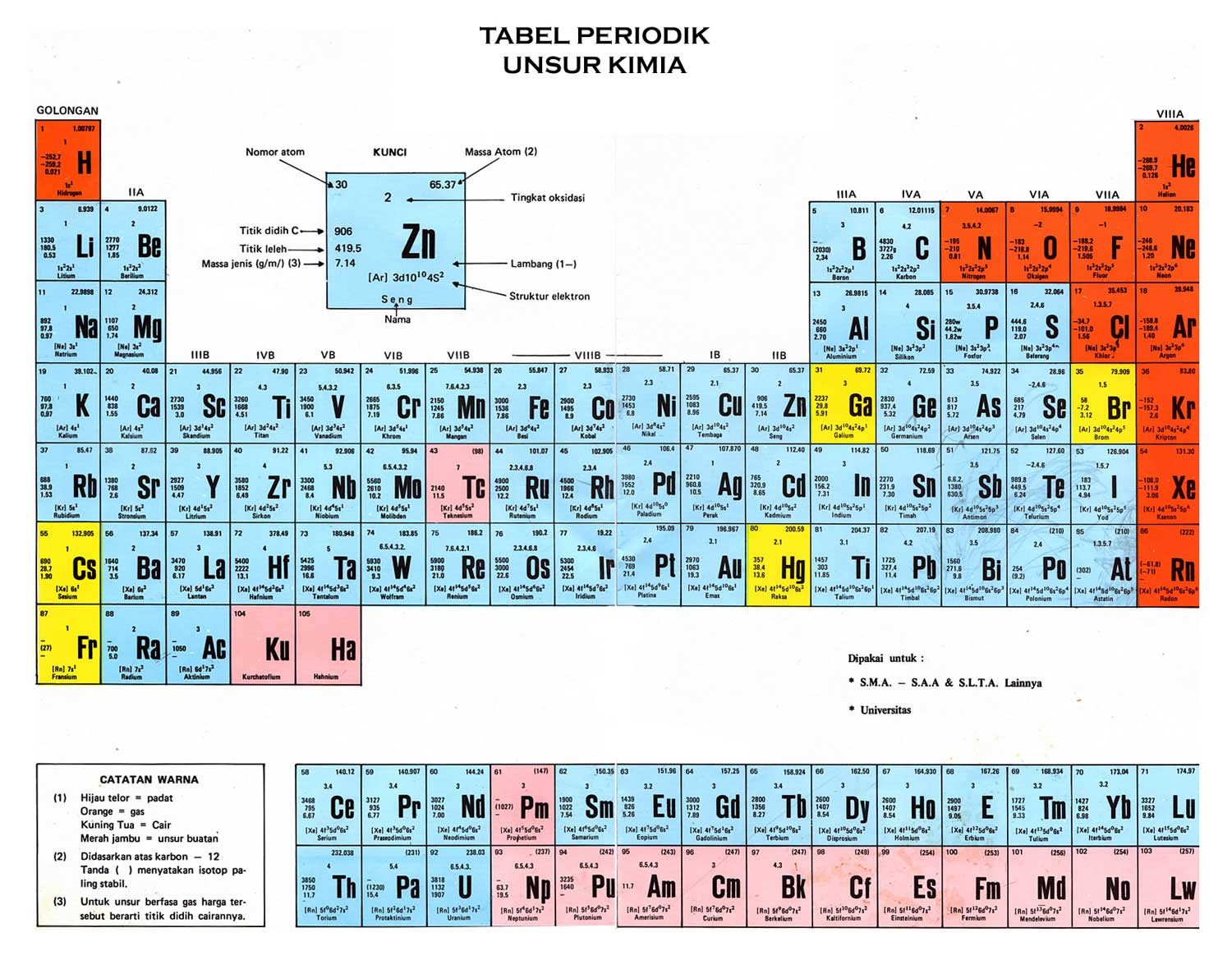
Tokoh-Tokoh Penyusunan Sistem Periodik Unsur
Dalam jurnal Sofia, 2017 dibahas bahwa selama lebih dari 200 tahun terjadi perkembangan pengelompokan unsur dalam tabel sistem periodik unsur. Pengelompokan unsur dikenal mulai dari Lavoisier (1789) mengelompokkan zat-zat berdasarkan sifat kimianya menjadi gas, logam, non-logam, dan tanah (Marshall.J.L. Beta Eta 1971 dan Marshall, V.R, Beta Eta 2003). Pengelompokan unsur ini masih sangat umum maka selanjutnya John Dalton (1808) mengajukan pengelompokan unsur berdasarkan masa atom. Ia mengelompokkan zat-zat berupa unsur-unsur (36 unsur) berdasarkan kenaikan masa atomnya. Hal ini didasarkan pada teorinya bahwa unsur dari atom yang berbeda mempunya sifat dan masa atom yang berbeda.
Selanjutnya Jons Jacob Berzelius (1828) berhasil membuat daftar masa atom unsur-usnsur yang akurat. Hal ini menarik perhatian ilmuan lainnya untuk mengelompokkan unsur-unsur berdasarkan kenaikan masa atom. Johann Wolfgang Döbereiner (1780- 1849) di universitas jena mempelajari hubungan sifat kimia dan masa atom. Döbereiner menentukan masa atom dengan menganalisis mineral sulfat yang dinamakan Celestine (stronsium) dari sebuah tambang. Dia menentukan masa Celestine rata-rata masa atom Kalsium dan Barium. Para ahli menilai Dobereiner tidak membedakan beberapa elemen karena masa atom elemem yang lain tidak dapat ditentukan, semua elemen tidak bisa diatur dalam bentuk triad.
John Alexander Reina Newlands mengamati pengulangan sifat antara unsur satu dengan unsur kedelapan maka ia mengajukan hukum oktaf newland. Newlands mempublikasikan klasifikasi elemen berdasarkan hubungan masa atom dan sifat kimia, pada tahun 1865 Newlands menyusun unsur berdasarkan kenaikan masa atom.
Lothar Meyer (1864) melakukan pengamatan hubungan
antara kenaikan masa atom dengan kepriodikan sifat unsur, jika setiap elemen
diatur dalam urutan masa atom, mereka berada dalam kelompok kimia
dan fisik sifat
yang mirip diulang pada interval periodic
dengan membuat kurva volume atom versus fungsi masa atom.
Chancourtois(1862) menyusun unsur berdasarkan kenaikan masa atom dan kemiripan sifat. Ia menyusun unsur berdasarkan kenaikan masa atom sepanjang spiral tertulis pada permukaan silinder dan cenderung di 45 derajat dari dasar.
Newlands dan De Chancourtois tidak membuat tabel sistem periodikterbuka yang tidak memberikan peluang ditemukannya unsur baru. Kelemahan ini diperbaiki oleh Dmitri Mendeleev (1869), iamempublikasikan tabel periodik semua elemen yang diketahui, ia memperkirakan beberapa elemen baru untuk menyelesaikan tabel, dan mengoreksi beberapa bobot atom. Ia menemukan unsur-unsur dengan sifat-sifat yang mirip terletak pada kolom yang sama, misalnya unsur Na dan K merupakan logam yang sangat reaktif, terletak pada kolom yang sama, unsur F dan Cl adalah non-logam yang sangat reaktif.
 |
| mastah.org |
5. Kesimpulan
Atom merupakan bagian terkecil dari materi yang tidak dapat dibagi-bagi lagi. Atom disusun oleh partikel-partikel subatom yaitu elektron (-), proton (+), dan neutron.
Teori kuantum yang dikemukakan Max Planck (1900) menyatakan, bahwa energi suatu materi hanya dapat berubah (bertambah atau berkurang) dengan suatu kelipatan satuan energi yang disebut kuantum. Teori atom Bohr yang dikemukakan oleh Niels Bohr (1885-1962) pada tahun 1913 menyusun model atom hidrogen berdasarkan teori atom Rutherford dan teori kuantum Planck, dengan dua postulat yang sangat fundamental. Model atom dan penyusunnya perlu dipelajari untuk menambah ilmu pengetahuan kita tentang atom.
Pengelompokkanunsur dimulai dari Lavoiser, Dalton, Berzelius yang mengelompokkan unsur secara umum dan kenaikan masa atom. Selanjutnya Doberiner, Newlands, Meyer, De chancourtouis, Mendeleev menyusun unsur berdasarkan kemiripan dan keperiodikan sifat unsur. Penyusunan tabel sistem periodik mengalami evolusi dimana para ahli diatas mempelajari unsur berdasarkan penelitian sebelumnya. Perkembangan tabel sistem periodik yang baru megandung tabel periodik unsur para ahli sebelumnya. Hal ini sesuai dengan teori evolusi perkembangan sains yang dikemukakan popper (Firman. 2015 dalam Sofia, 2017).
Daftar Pustaka
Arief, Alimufi dkk. 2014. Model Atom. Dalam http://repository.ut.ac.id/4514/2/PEFI4421-M1.pdf. Universitas Terbuka, Jakarta, pp. 1-53. ISBN 9789790113350. Diakses pada 26 September 2021.
Farida, Ida. 2009. Analisis Sejarah Perkembangan Model Atom Berdasarkan Paradigma Kuhn. Dalam http://digilib.uinsgd.ac.id/13183/1/Analisis%20Sejarah%20Perkembangan%20Model%20Atom%20Berdasarkan%20Paradigma.pdf. Diakses pada 26 September 2021. (Keenan, Charles W. et all. 1980. General College Chemistry. Sixth Ed. NY. Harper & Row Publishers, Inc.)
Hidayat, Atep Afia. 2021. Struktur Atom dan Sistem Periodik Unsur. Dalam Kimia dan Pengetahuan Lingkungan Industri. Jakarta: Universitas Mercu Buana.
Sofia, S. 2017. TABEL SISTEM PERIODIK UNSUR: EVOLUSI ATAU REVOLUSI. Dalam Jurnal Penelitian Pendidikan Kimia: Kajian Hasil Penelitian Pendidikan Kimia, 4(1), 28-35. https://ejournal.unsri.ac.id/index.php/jurpenkim/article/view/8201/0. Diakses pada 21 September 2021.
Ismunandar. 2013. Kimia Dasar I : Struktur Atom. Dalam https://youtu.be/aLVrlGdYmEA. Bandung: ITB. Diakses pada 24 September 2021.
Tidak ada komentar:
Posting Komentar
Catatan: Hanya anggota dari blog ini yang dapat mengirim komentar.