Oleh: @K01-IRVIN, @K02-ERLANGGA, @K03-SYAIFUL, @KEL-K01
Pengertian
Termodinamika
Termodinamika merupakan ilmu yang mempelajari hubungan antara usaha dan kalor. Di dalam termodinamika kita mengenal adanya sistem dan lingkungan. Dalam termodinamika sistem diarttikan sebagai kumpulan dari benda – benda atau objek yang diteliti atau menjadi pusat perhatian kita sedangkan lingkungan diartikan sebagai benda atau objek yang berada di luar sistem.
Termodinamika merupakan ilmu yang mempelajari hubungan antara usaha dan kalor. Di dalam termodinamika kita mengenal adanya sistem dan lingkungan. Dalam termodinamika sistem diarttikan sebagai kumpulan dari benda – benda atau objek yang diteliti atau menjadi pusat perhatian kita sedangkan lingkungan diartikan sebagai benda atau objek yang berada di luar sistem.
Hukum I
Termodinamika
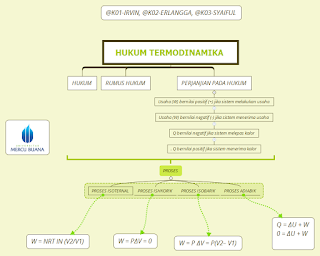
Hukum I termodinamika menyatakan bahwa "Jumlah kalor pada suatu sistem adalah sama dengan perubahan energi di dalam sistem tersebut ditambah dengan usaha yang dilakukan oleh sistem."
disimpulkan bahwa perubahan energi dalam pada sistem tertutup merupakan selisih kalor yang diterima dengan usaha yang dilakukan sistem.
Hukum I termodinamika menyatakan bahwa "Jumlah kalor pada suatu sistem adalah sama dengan perubahan energi di dalam sistem tersebut ditambah dengan usaha yang dilakukan oleh sistem."
disimpulkan bahwa perubahan energi dalam pada sistem tertutup merupakan selisih kalor yang diterima dengan usaha yang dilakukan sistem.
Rumus Hukum
I Termodinamika
Dari bunyi hukum I Termodinamika, maka rumus hukum I Termodinamika dapat dituliskan sebagai berikut :
Q = ∆U + W atau ∆U = Q – W atau
Keterangan:
∆U : Perubahan energi dalam sistem (J)
Q : Kalor yang diterima/dilepas sistem (J)
W : Usaha (J)
Dari bunyi hukum I Termodinamika, maka rumus hukum I Termodinamika dapat dituliskan sebagai berikut :
Q = ∆U + W atau ∆U = Q – W atau
Keterangan:
∆U : Perubahan energi dalam sistem (J)
Q : Kalor yang diterima/dilepas sistem (J)
W : Usaha (J)
Perjanjian
pada hukum I Termodinamika
Rumus hukum I Termodinamika digunakan dengan perjanjian sebagai berikut :
1. Usaha (W) bernilai positif (+) jika sistem melakukan usaha
2. Usaha (W) bernilai negatif (-) jika sistem menerima usaha
3. Q bernilai negatif jika sistem melepas kalor
4. Q bernilai positif jika sistem menerima kalor
Rumus hukum I Termodinamika digunakan dengan perjanjian sebagai berikut :
1. Usaha (W) bernilai positif (+) jika sistem melakukan usaha
2. Usaha (W) bernilai negatif (-) jika sistem menerima usaha
3. Q bernilai negatif jika sistem melepas kalor
4. Q bernilai positif jika sistem menerima kalor
Proses dalam
Termodinamika
proses-proses dalam termodinamika terbagi atas empat jenis,
yaitu isotermal, isokhorik, isobarik, dan adiabatik:
1 1. Proses isotermal
Anda telah memahami bahwa proses
isotermal merupakan suatu proses yang terjadi dalam sistem pada suhu tetap.
Besar usaha yang dilakukan sistem proses isotermal ini adalah W = nRT In
(V2/V1). Oleh karena ΔT = 0, menurut Teori Kinetik Gas, energi dalam sistem
juga tidak berubah (ΔU= 0) karena perubahan energi dalam bergantung pada
perubahan suhu. Ingatlah kembali persamaan energi dalam gas monoatomik yang
dinyatakan dalam persamaan ΔU=(3/2)nRΔT. Dengan demikian, persamaan Hukum
Pertama Termodinamika untuk proses isotermal ini dapat dituliskan sebagai
berikut.
Q
= ΔU + W = 0 + W
Q
= W = nR T ln (V2/V1) …. (9-10)
2. Proses iskhorik
Dalam proses isokhorik perubahan yang
dialami oleh sistem berada dalam keadaan volume tetap. Anda telah memahami
bahwa besar usaha pada proses isokhorik dituliskan W = pΔV = 0. Dengan
demikian, persamaan Hukum Pertama Termodinamika untuk proses ini dituliskan
sebagai .
Q
= ΔU + W = ΔU + 0
Q
= ΔU = U2 — U1
Dari Persamaan (9-11) Anda dapat menyatakan
bahwa kalor yang diberikan pada sistem hanya
digunakan untuk mengubah energi dalam sistem tersebut. Jika persamaan energi
dalam untuk gas ideal monoatomik disubstitusikan ke dalam Persamaan (9-11),
didapatkan perumusan Hukum Pertama Termodinamika pada proses isokhorik sebagai
berikut.
Q
= ΔU =(3/2)nR ΔT …(9-12)
atau
Q
= U2 — U1 =(3/2)nR (T2 —T1) …. (9-13)
3. 3. Proses Isobarik Jika gas mengalami proses
isobarik, perubahan yang terjadi pada gas berada dalam keadaan tekanan tetap.
Usaha yang dilakukan gas dalam proses ini memenuhi persamaan W = P ΔV = p(V2–
V1). Dengan demikian, persamaan Hukum Pertama Termodinamika untuk proses
isobarik dapat dituliskan sebagai berikut.
Q
= ΔU + W
Q
= ΔU + p(V2 – V1) … (9-14)
Untuk gas ideal monoatomik, Persamaan (9-14)
dapat dituliskan sebagai.
Q =(3/2)nR (T2 — T1) + p (V2 – V1) … (9-15)
4 4. Proses adiabatik Dalam pembahasan mengenai
proses adiabatik, Anda telah mengetahui bahwa dalam proses ini tidak ada kalor
yang keluar atau masuk ke dalam sistem sehingga Q = 0. Persamaan Hukum Pertama
Termodinamika untuk proses adiabatik ini dapat dituliskan menjadi.
Q = ΔU + W
0 = ΔU + W
Atau
W = — ΔU = —(3/2)nR (T2 – T1)
Contoh soal
1.
Suatu system menyerap kalor
sebesar 60 kJ pada suhu 27°C. Berapakah peubahan entropi system ini?
Penyelesaian:
Diketahui:
Q = 60 kJ = 60. 000J
T = 27°C = 300 K
Ditanyakan:
∆S = Q/T
= 60000 j/300 j
= 200 j/k
2.
Ke dalam 100 ml
larutan HNO3 2 M dengan suhu 2 C ditambahkan 100 ml larutan KOH 2 M dengan suhu
25 C. ternyata, suhu campuran naik sampai 40 C. Jika kalor jenis air = 4,2 j/g.
maka perubahan entalpi reaksi adalah... j/mol
→ Pertama, kita cari jumlah kalor yang dihasilkan !
q = m . c . ⧍T
= 200 . 4,2 . 15
= 12600 j atau 12,6 kj
Reaksi Penetralan :
HNO3 + KOH → KNO3 + H2O
Jumlah mol = V . M = 0,1 x 2 = 0,2 mol
Maka ⧍H = 12,6 / 0,2 = 63 Kj
→ Pertama, kita cari jumlah kalor yang dihasilkan !
q = m . c . ⧍T
= 200 . 4,2 . 15
= 12600 j atau 12,6 kj
Reaksi Penetralan :
HNO3 + KOH → KNO3 + H2O
Jumlah mol = V . M = 0,1 x 2 = 0,2 mol
Maka ⧍H = 12,6 / 0,2 = 63 Kj
Daftar pustaka
Nurrahmi, Sitti. 2016. Termodinamika 1.
Anonim. 2015. Dengan artikel “Hukum I Termodinamika”
Mulyadi. 2016. “Termodinamika: Pengertian,hukum, dan jenis
sistem termodinamika”. https://budisma.net/2015/05/termodinamika-pengertianhukum-dan-jenis-sistem-termodinamika.html .
Iman. 2011. “Sistem
Termodinamika”. https://nurulimantmunib.wordpress.com/2011/08/14/sistem-thermodinamika/ .
@K04-Bayu, @K05-Risza, @k06-Faisal, @Kel-K02
BalasHapusSoal:
Kalor sebanyak 2000 Joule ditambahkan pada sistem dan lingkungan melakukan usaha 2500 Joule pada sistem. Perubahan energi dalam sistem adalah…
Begini pembahasannya
HapusDik :
Q=2000 joule
W=-2500 joule
Dit :∆U?
Jwb :
Q=∆U + W
∆U = Q - W
∆U = 2000 - (-2500)
∆U = 2000 + 2500
∆U = 4500 joule