ABSTRAK
Sifat gas, cairan, dan
padatan yang paling jelas dapat dilihat dari perilakunya ketika di pindahkan
dari satu wadah ke wadah lain. Wujud gas, akan mengembang untuk memenuhi
seluruh wadah yang ditempati, sehingga volume dan bentuk gas akan selalu
berubah-ubah. Hal ini disebabkan karena gaya tatik antar molekul begitu lemah
sehingga molekul-molekul bergerak dengan cepat dan mengembang yang akhirnya
mengisi wadah.
Kata Kunci : Sifat Gas,Volume,
Mol.
ABSTRACT
The most obvious properties of gases, liquids and solids can be seen from
their behavior when transferred from one container to another. In gas form, it
will expand to fill the entire container it is in, so the volume and shape of
the gas will always change. This is because the static forces between molecules
are so weak that the molecules move quickly and expand, eventually filling the
container.
Keywords: Gas Properties, Volume, Mol.
PENDAHULUAN
Pada tahun 1808, pakar
kimia Perancis, Joseph Louis Gay – Lussac menyimpulkan hasil percobaan tetang
reaksi gas, bahwa: “volume gas – gas yang bereaksi pada suhu dan tekanan
tertentu berbanding sebagai bilangan bulat dan sederhana ”. Tiga tahun
berikutnya, pakar kimia Italia, Amedeo Avogadro menafsirkan hukum perbandingan
volume yang dikenal dengan hipotesis Avogandro, dan sekarang telah menjadi
teori Avogandro yaitu: “Setiap gas yang memiliki volume sama pada suhu dan
tekanan sama mengandung jumlah molekul yang sama”. Jadi, dua volume hidrogen
mengandung dua kali jumlah molekul untuk satu volume oksigen. Hal ini sejalan
dengan persamaan reaksi kimia.
Karena hukum – hukum
gas tidak bergantung pada jati diri gas. Dengan kata lain gas apa saja, pada
suhu dan tekanan tertentu volumenya akan sama. Hal ini berimplikasi bahwa, satu
mol setiap gas mengandung jumlah molekul yang sama dengan tetapan avogadro (L =
6,02 x 1023 molekul). Menurut Hukum Avogandro, gas – gas
tersebut harus mengisi volume yang sama pada suhu dan tekanan tertentu. Volume
satu mol gas ini dikenal dengan volume molar gas. Pada tekanan
standar (0 oC dan 1 atm), volume satu mol gas ditemukan sebesar
22,4 Liter. (Hanya pada 0 oC dan 1 atm, jika tidak dalam
kondisi tersebut maka volume molarnya tidak akan 22,4 L)
RUMUSAN
MASALAH
- ·
Kondisi Apa Saja Yang Mempengaruhi Sifat
Gas ?
- · Bagaimana Cara Menghitung Volume Gas ?
TUJUAN
PEMBELAJARAN
- · Mengetahui Sifat – Sifat Gas
- · Memahami Cara Menghitung Volume Gas
PEMBAHASAN
Seperti yang telah
disinggung sebelumnya, hipotesis Avogadro menyebutkan bahwa pada suhu dan
tekanan yang sama, semua gas dengan volume yang sama akan mengandung jumlah
partikel yang sama pula. Oleh karena 1 mol setiap gas mempunyai jumlah molekul
yang sama, maka pada suhu dan tekanan yang sama pula, 1 mol setiap gas memiliki
volume yang sama. Volume per mol gas disebut volume molar dan
dilambangkan dengan Vm. Secara matematis, hubungan volume, mol dan
volume molar dinyatakan dalam rumus berikut.
|
V
= n × Vm |
Keterangan:
V = volume gas (liter)
n = jumlah mol (mol)
Vm =
volume molar (liter/mol)
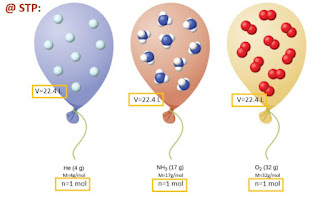
1.) Keadaan Standar
Sumber : https://www.google.com/url?sa=i&url
Kondisi dengan suhu 0
°C (273 K) dan tekanan 1 atm (76 cmHg) disebut dengan keadaan standar dan
dinyatakan dengan STP (Standard Temperature and Pressure). Keadaan
tersebut, apabila dimasukkan ke dalam rumus gas ideal menghasilkan nilai
sebagai berikut.
|
PV = nRT |
Keterangan:
P = tekanan (atm)
V = volume gas (liter)
n = jumlah mol (mol)
R = tetapan gas = 0,082
L atm/mol K
T = 0 °C = 273 K
Dari persamaan gas
ideal di atas, kita peroleh rumus volume gas sebagai berikut.
|
V |
= |
nRT |
|
P |
Untuk keadaan STP,
nilai P = 1 atm, n = 1 mol, R = 0,082 L atm/mol K dan T = 273 K. Sehingga
apabila kita masukkan nilai-nilai tersebut ke rumus volume di atas, maka kita
peroleh:
|
V |
= |
1 mol × 0,082 L
atm/mol K × 273 K |
= |
22,4 liter |
|
1 atm |
Dengan demikian, pada
keadaan standar (STP), volume molar (volume 1 mol gas) adalah 22,4 liter/mol.
Sehingga untuk
menghitung volume gas pada keadaan STP adalah dengan mengalikan mol gas dengan
22,4
Secara matematis,
V = n mol x 22,4 L/mol
2.) Keadaan Kamar
ondisi pengukuran gas pada suhu 25 °C dan tekanan 1 atm disebut keadaan
kamar dan dinyatakan dengan RTP (Room Temperature and Pressure).
Keadaan tersebut, apabila dimasukkan ke dalam rumus gas ideal menghasilkan
nilai sebagai berikut.
|
PV = nRT |
Keterangan:
P = tekanan (atm)
V = volume gas (liter)
n = jumlah mol (mol)
R = tetapan gas = 0,082 L atm/mol K
T = 25 °C = 298 K
Dari persamaan gas ideal di atas, kita peroleh rumus volume gas sebagai
berikut.
|
V |
= |
nRT |
|
P |
Untuk keadaan RTP, nilai P = 1 atm, n = 1 mol, R = 0,082 L atm/mol K dan
T = 298 K. Sehingga apabila kita masukkan nilai-nilai tersebut ke rumus volume
di atas, maka kita peroleh:
|
V |
= |
1 mol × 0,082 L atm/mol K × 298 K |
= |
24,4 liter |
|
1 atm |
Dengan demikian, pada keadaan kamar (RTP), volume molar (volume 1 mol
gas) adalah 24,4 liter/mol.
Sehingga untuk
menghitung volume gas pada keadaan RSTP adalah dengan mengalikan mol gas dengan
24,4.
Secara matematis,
V = n mol x 24,4 L/mol
3.) Keadaan Tertentu
(Suhu dan Tekanan Diketahui)
Suatu keadaan dimana
suhu dan tekanan telah diketahui disebut juga sebagai keadaan tidak
standar (Non-STP) sehingga pada keadaan ini, volume gas dapat dihitung
dengan menggunakan persamaan gas ideal. Persamaan gas ideal yaitu
PV = nRT. Dari persamaan gas ideal ini, untuk menentukan volume gas dapat kita
gunakan rumus sebagai berikut.
|
V |
= |
nRT |
|
P |
Keterangan:
P = tekanan (atm)
V = volume gas (liter)
n = jumlah mol (mol)
R = tetapan gas = 0,082
L atm/mol K
T = suhu mutlak gas (K
= 273 + suhu celcius)
4.) Keadaan yang
Mengacu pada Keadaan Gas Lain
Pada suhu dan tekanan yang sama, volume gas hanya bergantung pada jumlah molnya. Misalkan gas pertama dengan jumlah mol n1 dan volume V1 dan gas kedua dengan mol n2 dan volume V2, maka pada suhu dan tekanan yang sama berlaku persamaan berikut ini.
(n1/V1) = (n2/V2)
Keterangan:
V1 dan
n1 adalah volume dan mol gas 1
V2 dan
n2 adalah volume dan mol gas 2
CONTOH
SOAL
- Tentukanlah volume dari 2 mol gas nitrogen jika diukur pada :
a.)
keadaan standar (STP)
b.)
keadaan kamar (RTP)
c.)
suhu 30 °C dan tekanan 1 atm
d.) suhu
dan tekanan yang sama di mana 0,5 mol gas oksigen mempunyai volume 15 liter
Jawab:
a.) Pada keadaan
standar (STP), Vm = 22,4 liter/mol sehingga:
V = n × Vm
V = 2 mol × 22,4
liter/mol
V = 44,8 liter
Jadi, volume 2 mol gas
nitrogen pada keadaan STP adalah 44,8 liter.
b.) Pada keadaan
kamar (RTP), Vm = 24,4 liter/mol sehingga:
V = n × Vm
V = 2 mol × 24,4
liter/mol
V = 48,8 liter
Jadi, volume 2 mol gas
nitrogen pada keadaan RTP adalah 48,8 liter.
c.) Pada suhu 30
°C dan tekanan 1 atm atau keadaan non-standar, kita gunakan persamaan gas ideal
sebagai berikut.
T = 273 + 30 = 303 K
PV = nRT
V = nRT/P
V = (2 mol × 0,082 L
atm/mol K × 303 K)/(1 atm)
V = 49,692 liter
Jadi, volume 2 mol gas
nitrogen pada suhu 30 °C dan tekanan 1 atm adalah 49,69 liter.
d.) Pada suhu dan
tekanan yang sama pada saat 0,5 mol gas oksigen volumenya 15 liter, volume gas
nitrogen dapat kita cari dengan rumus berikut.
V1/V2 =
n1/n2
(V O2)/(V N2)
= (n O2)/(n N2)
(15 liter)/(V N2)
= (0,5 mol)/(2 mol)
(15 liter)/(V N2)
= ¼
V N2 =
(15 liter)/(¼)
V N2 =
60 liter
Jadi, volume 2 mol gas
nitrogen pada saat 0,5 mol gas oksigen volumenya 15 liter adalah 60 liter.
PENUTUP
Pada hukum - hukum gas
terdapat hubungn antara tekanan, temperature, dan volume. Secara pendekatan
hukum-hukum gas tersebut tetap bisa digunakan untuk menentukan pengaruh
daripada perubahan tekanan temperature dan volume. Perubahan volume akan
berbanding lurus dengan perubahan temperatur absolut pada tekanan yang konstan.
Apabila gas dipanaskan maka temperaturnya akan naik dan volume pun turut naik,
begitu pula sebaliknya jika gas didinginkan. Apabila pada temperatur tetap jika
volume gas dinaikkan maka tekanan absolutnya akan turun dan apabila pada volume
tidak dapat berubah bilamana dipanaskan atau didinginkan jika temperature
diperbesar maka berbanding lurus dengan tekanan.
DAFTAR
PUSTAKA
Heny E.H, Kimia Dasar, Deepublish, 2019. http://repository.unisda.ac.id/564/2/BUKU%20AJAR%20KIMIA%20DASAR.pdf,
(Diakses pada 21 Oktober 2023).
Furi A.F, Hukum
Gas dan Hubungan Volume Gas dari Persamaan Reaksi, SlideShare, 2014. https://www.slideshare.net/Fazrillash/edit-kimia. (Diakses pada 21 Oktober 2023).
UripInfo, Volume Molar Gas
pada Keadaan STP, NTP, dan RTP, (2023, 28 Maret). Diakses pada 21 Oktober 2023,
Dari https://www.urip.info/2023/03/volume-molar-gas-pada-keadaan-stp-ntp.html.

Tidak ada komentar:
Posting Komentar
Catatan: Hanya anggota dari blog ini yang dapat mengirim komentar.