Konsep Kimia Dasar: Dunia Kimia, Klasifikasi Materi dan Reaksi Kimia
Oleh Aryo Gusman ( @V08-Aryo )
Ilmu kimia adalah ilmu yang mempelajari tentang komposisi, sifat fisik dan kimia, perubahan materi serta energi yang menyertai perubahan tersebut. Komposisi (susunan) zat menyatakan perbandingan unsur pembentuk zat itu. Sebagai contoh, air dan etanol yang dirumuskan H2O dan C2H5OH. Struktur zat kimia menggambarkan letak atom-atom dalam ruang 3 dimensi. Gambar 1 di bawah ini merupakan contoh untuk struktur air dan etanol.
Dunia Kimia
Dalam dunia kimia yang telah disepakati oleh para ahli, terbagi menjadi 3 dunia yaitu dunia makroskopik, submikroskopik dan simbol
1. Makroskopik
Makroskopik adalah pengamatan fenomena kimia yang dapat dilihat langsung atau persepsi langsung yang dialami oleh seseorang dari percobaan di laboratorium atau kehidupan sehari-hari. Contohnya perubahan warna, terbentuknya gelembung gas, terbentuknya endapan, pelarutan garam, pH larutan dan perubahannya, adanya spektrum cahaya, dan perubahan suhu dalam reaksi kimia.
2. Submikroskopik
Submikroskopik adalah sesuatu yang tidak kasat mata melalui pendekatan konsep teori ilmiah dalam bidang kimia yang dapat digunakan untuk menjelaskan susunan serta pergerakan partikel (ion, elektron, molekul, dan atom).
3. Simbol
Simbol merupakan representasi yang melibatkan penggunaan simbol-simbol kimia secara kualitatif dan kuantitatif, yang meliputi rumus kimia, persamaan reaksi, bentuk gambar, diagram, aljabar, grafik, mekanisme reaksi, simbol kimia, struktur kimia, nomor, stoikiometri, perhitungan matematik, analogi dan model kit
Gambar 2. Tiga Dunia Kimia
Sifat & Perubahan Materi
Perubahan zat kimia dapat terjadi secara alami maupun karena perlakuan manusia. Untuk dapat mengetahui zat tersebut, dapat dilakukan identifikasi melalui sifat-sifat dan susunannya.
a. Sifat fisika
Sifat yang mengakibatkan perubahan secara fisik materi, contohnya warna, rasa, kekerasan, kelarutan, kerapatan, titik leleh, titik didih dan lain-lain.
b. Sifat kimia
Sifat yang memiliki kemampuan untuk mengalami perubahan atau reaksi secara kimiawi. Contohnya adalah kestabilan, daya ionisasi, kereaktifan.
Perubahan materi dapat dikasifikasikan menjadi 2, yaitu perubahan fisika dan perubahan kimia.
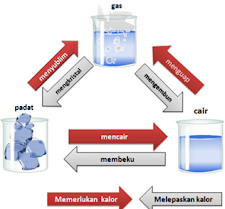
a. Perubahan fisika disebabkan oleh ulah manusia, dimana hal ini tidak membuat suatu zat menghasilkan zat baru tanpa mengubah susunan suatu zat. Perubahan fisika akan membuat perubahan bentuk/wujud suatu zat karena adanya pengaruh perubahan suhu/temperatur lingkungan. Berdasarkan gambar 3, perubahan fisika dapat dirangkum menjadi 6 peristiwa diantaranya membeku, mencair, menyublim, menguap, mengembun dan mengkristal
b. Perubahan kimia merupakan perubahan yang akan menghasilkan zat baru. Pembakaran kayu merupakan salah satu contoh perubahan kimia yang sering kita jumpai sehari-hari. Kayu termasuk dalam benda organik, sehingga saat kayu dibakar akan menghasilkan reaksi H2O dan CO2. Pembakaran tersebut akan membuat zat baru yang berupa arang kayu.
Wujud Materi
Materi adalah segala sesuatu yang menempati ruang dan memilik massa. Dalam hal ini, materi memiliki 3 wujud yaitu padat, cair, dan gas. Ketiga wujud ini dapat berubah menjadi wujud yang lain.
a. Zat Padat, benda kaku dengan bentuk tetap memiliki molekul yang teratur dan gaya tarik menarik antar molekul kuat. Contoh : bolpoin, penghapus, buku, papan tulis, es batu
b. Zat Cair, mempunyai volume yang tetap dan bentuk berubah-ubah sesuai dengan tempatnya serta memiliki molekul yan kurang teratur. Contoh : air, minyak goreng, bensin, spirtus
c. Zat Gas, mempunyai bentuk dan volume yang tidak tetap
Klasifikasi Materi
Zat merupakan materi yang terdiri dari susunan tertentu atau tetap dan memiliki sifat-sifat tertentu. Materi terbagi menjadi zat murni dan campuran, yang mana zat murni digolongkan menjadi unsur dan senyawa.
1. Zat Murni/zat tunggal
a. Unsur
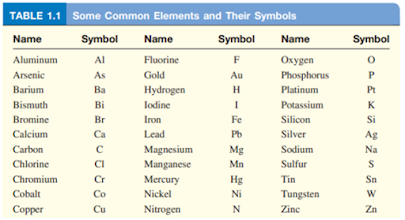
Salah satu golongan dari zat murni yang tidak bisa diuraikan kembali menjadi zat lain yang lebih sederhana dengan cara kimia. Unsur selalu ditandai dengan huruf kapital pada huruf pertama lambang, misalnya Na adalah lambang untuk Sodium, Zn adalah lambang untuk Zinc. Untuk lebih jelasnya dapat dilihat pada Gambar 4 dibawah ini:
b. Senyawa
Zat tunggal yang terdiri dari dua unsur atau lebih, memiliki komposisi yang tetap sehingga dapat diuraikan dengan cara kimia. Setiap senyawa memiliki sifat yang berbeda dengan unsur pembentuknya, sehingga hanya bisa diuraikan menjadi unsur-unsur pembentuknya melalui reaksi kimiawi. Senyawa terdiri dari senyawa organik dan anorganik.
1) Senyawa organik merupakan senyawa yang terbentuk oleh makhluk hidup atau organisme, mengandung karbon dan hidrogen serta elemen lainnya seperti nitrogen dan oksigen. Oleh karena itu CO, CO2 dan O2 bukanlah senyawa organik karena tidak mengandung hidrogen.
2) Senyawa anorganik merupakan senyawa yang tidak terbentuk dari karbon. Contoh: Natrium Klorida (NaCl), Oksigen (O2), Karbondioksida (CO2), Asam Nitrat (HNO3), Asam Klorida (HCl) dan lain-lan.
2. Campuran
Gabungan antara dua atau lebih zat tunggu dengan perbandingan yang tidak tetap atau sembarang. Campuran terbagi menjadi dua, yaitu homogen dan heterogen. Misalnya saat gula dilarutkan dalam air, susunannya diseluruh bagian larutan akan sama. Inilah yang disebut dengan campuran homogen. Untuk campuran heterogen, dapat diambil contoh air dan minyak, bubuk kopi dan gula. Campuran tersebut dapat berupa larutan, koloid maupun suspensi.
Untuk melakukan pemisahan campuran, dapat melalui proses fisika maupun kimia bergantung dengan jenis, sifat dan wujud komponennya. Campuran berwujud padat dan cair dapat dipisahkan dengan saringan. Kemudian untuk campuran homogen, seperti alkohol dalam air dapat dipisahkan dengan cara destilasi, rekristalisasi, ekstraksi dan kromatografi.
Reaksi Kimia
1. Reaksi Pembakaran
Reaksi dengan bahan yang mudah terbakar dengan pengoksidasi untuk menghasilkan produk yang teroksidasi. Contoh: 2Mg + O2 → 2MgO + Panas
Reaksi di mana dua atau lebih reaktan bergabung untuk membentuk satu produk tunggal dikenal sebagai reaksi kombinasi.
Contoh: 2Na + Cl2 → 2NaCl
3. Reaksi Dekomposisi (Penguraian)
Reaksi dimana satu senyawa terurai menjadi dua atau lebih senyawa yang lebih sederhana
Contoh: CaCO3 → CaO + CO2
4. Reaksi Perpindahan
Contoh: Zn + CuSO4 → ZnSO4 + Cu
5. Reaksi Perpindahan Ganda (Metatesis)
Reaksi perpindahan ganda terjadi di mana ion dipertukarkan antara dua reaktan yang membentuk senyawa baru.
Bentuk persamaan: XY + ZA → XZ + YA
Contoh: BBaCl2 + Na2SO4 → BaSO4 + 2NaCl
6. Reaksi Presipitasi
Reaksi kimia yang melibatkan pembentukan produk yang tidak larut (endapan; padatan)
Referensi
http://repo.stkip-pgri-sumbar.ac.id/id/eprint/3855/1/Kimia%20Dasar-Ratulani.pdf
http://repository.uhamka.ac.id/id/eprint/1238/1/BUKU%20AJAR%20KIMIA%20DASAR%20FIX.pdf
https://rumushitung.com/2016/12/03/perubahan-fisika-dan-perubahan-kimia/
https://www.gramedia.com/literasi/reaksi-kimia/



Tidak ada komentar:
Posting Komentar
Catatan: Hanya anggota dari blog ini yang dapat mengirim komentar.