Massa Molekuller dan Massa Atomik
Wahyu Visantoro (41623010005)
ABSTRAK
Pertama kali yang dijadikan standar massa atom adalah massa atom hidrogen, sebab unsur hidrogen memiliki massa atom paling ringan. Disamping itu, unsur hidrogen dapat membentuk senyawa dengan banyak unsur. Namun demikian, terdapat banyak kelemahan jika atom hidrogen ditetapkan sebagai standar massa atom, sebab massa atom hidrogen sangat kecil yang berdampak perubahan massa zat yang bersenyawa dengan hidrogen sukar ditentukan secara akurat (kesalahan pengukuran relatifPENDAHULUAN
Setiap atom memiliki massa tertentu yang disebut massa atom relatif (Ar). Apabila dua atau lebih atom bergabung, baik yang berasal dari unsur yang sama maupun berbeda, maka akan terbentuk molekul. Massa dari molekul ini disebut massa molekul relatif (Mr). Untuk mencari Mr, kita perlu menjumlahkan Ar dari seluruh atom penyusunnya. Nilai Ar dapat dilihat pada tabel periodik.
Massa atom relatif (Ar) dan massa molekul relatif (Mr) digunakan dalam menentukan massa molar. Di mana, massa molar menyatakan massa yang dimiliki oleh 1 mol zat yang besarnya sama dengan Ar atau Mr. Atau dapat dikatakan juga bahwa massa molar sama dengan massa satu mol zat yang dinyatakan dalam gram (gram/mol). Sebagai contoh: diketahui Mr H2O (air) adalah 18 gram/mol, artinya massa satu mol H2O sama dengan 18 gram.
RUMUSAN MASALAH
1. Jelaskan apa yang dimaksud Massa Molekuller
2. Jelaskan apa yang dimaksud Massa Atomik
TUJUAN
Untuk memahami perbedaan Massa Molekuller dan Massa Atomik,Serta mengetahui rumusnya mencarinya.
PEMBAHASAN
Massa molekul relatif
Molekul merupakan gabungan beberapa atom unsur dengan perbandingan tertentu. Unsur-unsur yang sama bergabung membentuk molekul unsur , sedangkan unsur-unsur yang berbeda membentuk molekul senyawa . Massa molekul suatu unsur atau senyawa dinyatakan dengan massa molekul relatif (Mr ) . Massa molekul relatif adalah perbandingan massa molekul suatu unsur atau senyawa dengan 1/12 × massa atom C-12. Secara matematis M r
Berdasarkan pengertian molekul yang menyatakan bahwa suatu molekul adalah gabungan atom-atomnya, maka M r adalah jumlah atom A r unsur-unsur penyusunnya.
Massa molekul relatif dapat dihitung menggunakan rumus berikut.
Jumlah atom diperoleh dari angka indeks pada rumus kimia. Misalnya, pada amonia () terdapat 1 atom dan 3 atom . Untuk senyawa yang memiliki indeks ganda, terdapat sedikit perbedaan. Keberadaan indeks ganda dalam senyawa dapat diidentifikasi dengan mudah karena dalam rumus kimianya terdapat tanda kurung. Jumlah atom dari unsur di dalam kurung adalah hasil kali dari kedua angka indeks. Sedangkan jumlah atom dari unsur di luar kurung sama dengan angka indeksnya sendiri, mengikuti aturan yang pertama tadi. Misalnya pada senyawa , terdapat 3 atom , 2 atom (), dan 8 atom ().
Massa Atomik
Massa atom relatif , rasio massa rata-rata atom suatu unsur kimia terhadap standar tertentu. Sejak tahun 1961 satuan standarmassa atom adalah seperduabelas massa atomisotop karbon-12 . Isotop adalah salah satu dari dua atau lebih spesies atom dari unsur kimia yang sama yang memiliki nomor massa atom berbeda ( proton + neutron ). Berat atom helium adalah 4,002602, rata-rata yang mencerminkan rasio khas kelimpahan isotop alaminya. Berat atom diukur dalamsatuan massa atom (amu), disebut juga dalton. Lihat di bawah untuk daftar unsur kimia dan berat atomnya .
Massa atom relatif (Ar) menyatakan perbandingan massa rata-rata satu atom suatu unsur terhadap satu per dua belas massa atom C – 12. Skala massa atom relatif disimbolkan sebagai Ar.
Massa atom relatif biasa disebut dengan singkatan Ar. Berdasarkan IUPAC (International Union of Pure and Applied Chemistry) yang digunakan sebagai standar penentuan massa atom relatif adalah atom C-12. Kemudian didapatkan rumus penentuan massa atom relatif (Ar) adalah perbandingan massa rata – rata unsur dengan satu per dua belas massa 1 atom C-12.Persamaan:
Jadi hubungan antara massa atom relatif dengan massa molekul relatif senyawa atau unsur adalah : Mr senyawa = ∑ Ar atom penyusun.
Perbedaan:
Kalau massa atom relatif adalah perbandingan massa suatu atom dengan massa atom lainnya, massa molekul relatif atau bobot molekul (BM) adalah perbandingan massa antara 1 molekul atau 1 satuan dari suatu zat terhadap 112 x massa atom isotop C-12.
CONTOH SOAL
1.Tentukan massa molekul relatif dari , jika diketahui , , dan .
jawab:
Terdapat masing-masing satu atom , , dan pada senyawa , sehingga massa molekul relatifnya dapat dicari dengan rumus berikut.Jadi, massa molekul relatif dari adalah 40.
2. Diketahui massa 1 atom oksigen 2,70 x 10–23 g, jika massa atom C adalah 1,99 10–23 g maka massa atom relatif O (Ar O) adalah
Diperoleh dari hasil perhitungan bahwa massa atom relatif okesigen atau Ar O = 16 gr/mol atau sering dibulatkan menjadi Ar O = 16. Massa atom relatif biasanya diketahui pada soal yang menjadi keterangan tambahan, selain itu Ar juga tercantum pada tabel periodik unsur.DAFTAR PUSTAKA
Agung Izullhaq 2019 Cara Mencari Mr https://www.kimiamath.com/post/massa-molekul-relatif-mr-senyawa
Blog Kimia 2017 Massa Molekul Relatif https://blogmipa-kimia.blogspot.com/2017/10/massa-molekul-relatif.html
UIN SUSKA 2018 https://repository.uin-suska.ac.id/13095/7/7.%20BAB%20II_2018562PK.pdf
Erik Gregersen 2023 atomic mass https://www.britannica.com/science/atomic-mass/additional-info
idschool.net Cara Hitung Massa Atom Relatif (Ar) dan Massa Molekul Relatif (Mr) https://idschool.net/sma/cara-menghitung-massa-atom-relatif-ar-dan-massa-molekul-relatif-mr/
.png)
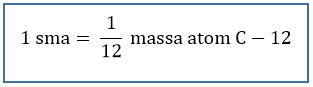

kerenn materi sangat mudah dipahami, materi juga ringkas sehingga enak dilihat
BalasHapusKeren dan mudah dipahami
BalasHapus