NABILA ALYA MUKHBITA (@Z13-NABILA)
ABSTRAK
Elektrokimia mempelajari semua reaksi kimia yang
disebabkan oleh energi listrik serta semua reaksi kimia yang menghasilkan
listrik. Namun sel elektrokimia sering didefinisikan sebagai sel yang
menghasilkan energi listrik akibat reaksi kimia dalam sel tersebut, seperti sel
galvani atau sel volta. Sedangkan sel yang menghasilkan reaksi kimia akibat
energi listrik disebut dengan sel elektolisis. Dalam hand out ini hanya akan
dibahas sel elektrokimia.
Sel elektrokimia dapat didefinisikan sebagai suatu sistem yang terdiri dari dua elektroda yang terpisah minimal oleh satu macam fasa elektrolit. Umumnya diantara kedua elektroda dalam sel elektrokimia tersebut terdapat perbedaan potensial yang terukur. Contoh sel elektrokimia misalnya sel Galvani, sel Daniel, baterei.
PENDAHULUAN
Korosi atau yang lebih dikenal dengan Pengkaratan merupakan salah satu contoh Reaksi
Reduksi-Oksidasi yang dapat kita jumpai sehari-hari, korosi unsur-unsur yang
berpotensial reduksi rendah (umumnya Besi, Fe). Akibat terjadinya korosi,
benda-benda logam menjadi lebih rapuh dan mudah hancur.
RUMUSAN
MASALAH
1.
Apa yang
dimaksud dengan Korosi?
2.
Bagaimana perlindungan
Korosi secara elektrokimia?
PEMBAHASAN
· Reaksi Korosi
Korosi merupakan proses dimana logam (umumnya besi)
teroksidasi oleh Air dan Gas Oksigen. Air dan Gas Oksigen akan bertindak
sebagai katode dan logam bertindak sebagai anode. Reaksi korosi terjadi
spontan, sehingga proses korosi bisa dikatakan mirip dengan Sel Volta.
Berikut ini adalah reaksi Korosi:
Selanjutnya ion Besi (II) akan kembali dioksidasi
menjadi Besi (III):
Perlindungan Korosi Secara Mekanik
Kaleng biskuit merupakan besi yang dilindungi secara galvanisasi oleh timah
Perlindungan Mekanik adalah perlindungan yang
dilakukan dengan cara menghindari permukaan logam agar tidak terkena udara
bebas yang mengandung oksigen dan uap air secara langsung. Hal ini dapat
ditempuh dengan cara:
1.
Mengecat
2.
Melumuri dengan Oli atau Gemuk
3.
Membuat Paduan Logam (Alloy)
Logam besi dapat dipadu dengan kromium (Cr) membentuk paduan Stainless
Steel, yaitu baja yang tahan karat karena telah dilindungi oleh lapisan
film oksida kromium.
4.
Melapisi dengan Plastik
Karena plastik merupakan polimer dari etilen (plastik bening) atau stirena (styrofoam)
yang merupakan senyawa organik yang terikat secara kovalen, sehingga sulit
dioksidasi
5.
Melapisi Dengan Logam Lain
(Galvanisasi)
Logam-logam dengan harga potensial reduksi sangat tinggi (di kanan deret
elektrokimia, seperti Emas, Platina, Perak, Tembaga, Timah) merupakan
logam-logam yang sangat sulit dioksidasi, logam tersebut dapat ditempatkan pada
bagian terluar benda untuk melindungi bagian dalamnya dari kontak dengan udara
langsung yang dapat menimbulkan korosi
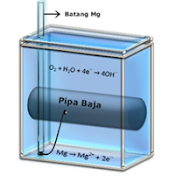
· Perlindungan Korosi Secara Elektrokimia
Perlindungan Elektrokimia atau sering disebut
sebagai Perlindungan Katodik (Cathodic Protection) adalah
proses perlindungan logam dengan mengorbankan logam lain yang potensial
reduksinya lebih kecil (semakin ke kiri deret elektrokimia).
Sebagai contoh adalah perlindungan besi dengan
magnesium. Besi dihubungkan dengan Magnesium menggunakan kabel, lalu Magnesium
akan bertindak sebagai anoda sementara besi sebagai katoda. Magnesium semakin
lama akan terkikis habis karena teroksidasi, namun besi akan tetap aman.
- Faktor-faktor
yang Mempercepat Korosi
Korosi dapat terjadi karena hal-hal yang alamiah
secara lambat maupun cepat. Proses korosi itu dapat terjadi karena beberapa
faktor di antaranya adalah:
1. Air
dan kelembapan udara
Air dan kelembapan udara merupakan salah satu faktor
utama yang menyebabkan terjadinya proses korosi. Jadi korosi yang terjadi
karena air dan kelembapan udara terjadi ketika kadar uap air di sekitar logam
tinggi. Semakin tinggi kadar uap akan semakin mudah pula logam mengalami
korosi.
Hal itu sekaligus menjawab alasan mengapa ketika besi
di dalam rumah yang diletakan di tempat yang lembap akan lebih cepat mengalami
korosi. Oleh sebab itu, sebisa mungkin simpan besi di tempat yang cenderung
kering agar tidak berkarat.
Sebab, ketika suatu logam berada di daerah kering
seperti gurun, proses korosi akan berjalan secara lambat karena kadar air yang
rendah.
2. Elektrolit
Elektrolit yang dimaksudkan di sini bukanlah minuman
yang bisa meningkatkan energ. Elektrolit yang dimaksudkan adalah media yang
dapat menjadi media untuk memindahkan muatan. Elektrolit dapat menyebabkan
oksigen di udara mengikat elektron lebih mudah.
Contoh nyata yang bisa dilihat adalah ketika handphone
anda jatuh ke dalam air laut atau air hujan, kemungkinan besar akan rusak dan
ketika didiamkan akan berkarat pada bagian mesinnya. Hal itu terjadi karena air
laut yang mengandung garam atau air hujan yang mengandung asam yang mampu
menjadi media yang mempercepat proses korosi.
Hal itu sekaligus menjawab alasan mengapa besi pada
lingkungan pabrik dapat mengalami korosi karena kerap terpapar senyawa
asam.
3. Permukaan
logam yang tidak rata
Tidak hanya faktor-faktor eksternal seperti air atau
elektrolit, tetapi bentuk permukaan pada logam juga berpengaruh pada proses
terjadinya korosi.
Semakin tidak rata suatu logam, akan semakin mudah
pula mengalami korosi. Hal tersebut dapat terjadi karena kutub-kutub muatan
pada permukaan logam dapat terbentuk. Padahal kutub muatan itu berperan sebagai
anoda dan katoda.
Oleh sebab itu, anda perlu selalu membersihkan
barang-barang yang mengandung logam dengan memastikan agar tetap licin supaya
mencegah terjadinya percepatan korosi.
4. Terbentuknya
sel elektrokimia
Sel elektrokimia dapat terbentuk karena dua permukaan
logam saling bersinggungan. Sel elektrokimia dapat terbentuk ketika permukaan
logam yang bersinggungan mengandung potensial elektroda yang berbeda.
Ketika sel elektrokimia terbentuk logam yang
mengandung potensial elektron lebih rendah bakal melepaskan elektron yang
menyebabkan oksidasi. Dan oksidasi itulah yang sebenarnya menyebabkan
terjadinya korosi.
DAFTAR PUSTAKA
Suroso
dkk. “Ensiklopedi Sains dan Kehidupan”, Cv. Tarity Samudra Berlian, 2003 [2].
Johannes
Leonard, Distribusi Tingkat Karat dan Laju Korosi Baja ST37 Dalam Lingkungan
Air Laut dan Air Tanah, Jurnal Mekanikal, Vol. 6 No. 1: Januari 2015
Trethewey,
(1991), Korosi untuk Mahasiswa Sains dan Rekayasawan, PT Gramedia Pustaka
Utama, Jakarta1.
Trethewey.
K.R, Chamberlain. J.”Korosi Untuk Mahasiswa dan Rekayasawan”. Diterjemahkan
Alex Trikantjono Widodo. Jakarta: PT. Gramedia Pustaka Utama, 1991.


Tidak ada komentar:
Posting Komentar
Catatan: Hanya anggota dari blog ini yang dapat mengirim komentar.