 |
| (Gambar 1: Mind Mapping) |
Oleh: Denny Farazumar Arief Kelana, Arnando, Muhammad Bayu Adji (Kel-J05, @J11-Denny, @J14-Arnando, @J17-Bayu).
ABSTRAK: Pada umumnya, senyawa dalam jasad hidup terdiri dari beberapa unsur yaitu: karbon, hidrogen, oksigen nitrogen dan disamping itu belerang dan fosfor. Kenyataan ini membawa kita pada defenisi. Jadi kimia organik ialah cabang ilmu kimia yang khusus mempelajari senyawa karbon. Oleh karena itu, sangat penting bagi kita untuk dapat mengetahui dan mempelajari tentang ikatan kimia dan senyawa organik. Karena dalam kehidupan sehari-hari, kita tidak akan pernah lepas dari hal-hal yang berhubungan dengan ikatan kimia dan senyawa organik.
IKATAN KIMIA.
Ikatan kimia adalah gaya tarik-menarik antara atom-atom sehingga atom-atom tersebut tetap berada bersama-sama dan terkombinasi dalam senyawaan. Gagasan tentang pembentukan ikatan kimia dikemukakan oleh Lewis dan Langmuir (Amerika) serta Kossel (Jerman). Dalam pembentukan ikatan kimia, golongan gas mulia (VIII A) sangat sulit membentuk ikatan kimia.
Ikatan Ionik.
Ikatan ion adalah ikatan yang terjadi akibat perpindahan elektron dari satu atom ke atom lain (James E. Brady, 1990). Ikatan ion terbentuk antara atom yang melepaskan electron (logam) dengan atom yang menangkap elektron (bukan logam). Atom logam, setelah melepaskan elektron berubah menjadi ion positif.
Sedangkan atom bukan logam, setelah menerima elektron berubah menjadi ion negatif. Antara ion-ion yang berlawanan muatan ini terjadi tarik-menarik (gaya elektrostastis) yang disebut ikatan ion (ikatan elektrovalen). Senyawa yang memiliki ikatan ion disebut senyawa ionik. Senyawa ionik biasanya terbentuk antara atom-atom unsur logam dan nonlogam.
Adapun sifat-sifat senyawa ikatan ionik, diantaranya:
- Dalam bentuk padatan tidak menghantar listrik karena partikel-partikel ionnya terikat kuat pada kisi, sehingga tidak ada elektron yang bebas bergerak.
- Leburan dan larutannya menghantarkan listrik.
- Umumnya berupa zat padat kristal yang permukaannya keras dan sukar digores.
- Titik leleh dan titik didihnya tinggi.
- Larut dalam pelarut polar dan tidak larut dalam pelarut nonpolar.
Ikatan Kovalen.
Ikatan kovalen adalah ikatan yang terjadi akibat pemakaian pasangan elektron secara bersama-sama oleh dua atom (James E. Brady, 1990). Ikatan kovalen terbentuk di antara dua atom yang sama-sama ingin menangkap elektron (sesama atom bukan logam).
Pasangan elektron yang dipakai bersama disebut pasangan electron ikatan (PEI) dan pasangan elektron valensi yang tidak terlibat dalam pembentukan ikatan kovalen disebut pasangan elektron bebas (PEB). Ikatan kovalen umumnya terjadi antara atom-atom unsur nonlogam, bisa sejenis (contoh: H2, N2, O2, Cl2, F2, Br2, I2) dan berbeda jenis (contoh: H2O, CO2, dan lain-lain). Senyawa yang hanya mengandung ikatan kovalen disebut senyawa kovalen.
Ikatan kovalen terdiri dari:
- Ikatan Kovalen NonPolar.
Ikatan kovalen nonpolar yaitu ikatan kovalen yang PEInya tertarik sama kuat ke arah atom-atom yang berikatan. Senyawa kovalen nonpolar terbentuk antara atom-atom unsur yang mempunyai beda keelektronegatifan nol atau mempunyai momen dipol = 0 (nol) atau mempunyai bentuk molekul simetri. Titik muatan negative electron persekutuan berhimpit, sehingga pada molekul pembentuknya tidak terjadi momen dipol, dengan perkataan lain bahwa elektron persekutuan mendapat gaya tarik yang sama.
Ikatan Kovalen NonPolar terdiri dari:
- Ikatan Kovalen Tunggal.
Ikatan kovalen tunggal yaitu ikatan kovalen yang memiliki 1 pasang PEI.
Contoh: H2, H2O (konfigurasi elektron H = 1; O = 2, 6).
- Ikatan Kovalen Dua Rangkap.
Ikatan kovalen rangkap 2 yaitu ikatan kovalen yang memiliki 2 pasang PEI.
Contoh: O2, CO2 (konfigurasi elektron O = 2, 6; C = 2, 4).
-Ikatan Kovalen Tiga Rangkap.
Ikatan kovalen rangkap 3 yaitu ikatan kovalen yang memiliki 3 pasang PEI.
Contoh: N2 (Konfigurasi elektron N = 2, 5). - Ikatan Kovalen Polar.
Ikatan kovalen polar adalah ikatan kovalen yang PEInya cenderung tertarik ke salah satu atom yang berikatan. Kepolaran suatu ikatan kovalen ditentukan oleh keelektronegatifan suatu unsur. Senyawa kovalen polar biasanya terjadi antara atom-atom unsur yang beda keelektronegatifannya besar, mempunyai bentuk molekul asimetris, mempunyai momen dipol. Ikatan kovalen yang terjadi antara dua atom yang berbeda disebut ikatan kovalen polar. Ikatan kovalen polar dapat juga terjadi antara dua atom yang sama tetapi memiliki keelektronegatifan yang berbeda.
- Titik Didih.
- Volatitilitas (Kemampuan untuk menguap).
- Kelarutan.
- Daya hantar listrik.
Untuk memahami ikatan koordinasi, marilah kita lihat senyawa amoniak. Amoniak atau NH3 terdiri atas satu atom N dan 3 atom H. Ini terjadi karena elektron terluar atom N terdiri atas sepasang elektron dan 3 elektron tunggal sehingga ikatan kovalen yang terjadi adalah NH3 dengan struktur:
| (Gambar 2: Struktur NH3) |
Bagaimana seandainya satu atom H akan masuk ke dalam molekul tersebut?. Seandainya atom H bisa masuk, yang paling mungkin adalah ke bagian yang ada elektron bebasnya, sehingga strukturnya akan menjadi:
| (Gambar 3: Atom H masuk ke dalam molekul) |
Tetapi, hitunglah sekarang ada berapa elektron yang mengelilingi N ? Ternyata ada 9 elektron, dan ini melanggar kaidah oktet, sehingga tidak mungkin atom H ke empat masuk ke dalam N yang sudah mengikat tiga atom H.
Tetapi lain halnya jika hidrogen yang ke empat itu sudah membuang elektronnya. Hidrogen yang sudah membuang satu-satunya elektron yang dimiliki, sudah bukan lagi atom hidrogen tetapi ion H+. Jika yang masuk sebagai hidrogen ke empat adalah H+, maka hal itu boleh terjadi, dan terbentuklah radikal NH yang disebut radikal amonium. Strukturnya adalah :
| (Gambar 4: Contoh Ikatan Koordinasi) |
Contoh Ikatan Kimia dalam Kehidupan Sehari-hari.
Contohnya adalah air. Air merupakan materi yang penting bagi kehidupan. Sebagian besar kebutuhan pokok kita menggunakan air. Bahkan dalam tubuh, air penting untuk menjaga DNA dari kerusakan, mengantarkan nutrisi ke seluruh bagian tunuh, dan menjaga keseimbangan suhu tubuh. Kita mengetahui air memiliki rumus senyawa H2O. Air tersusun dari unsur-unsur hidrogen dan oksigen.
Tanpa kita sadari bahwa kita sedang berhadapan dengan contoh aplikasi dari unsur-unsur yang berikatan, yang kemudian membentuk senyawa. Mungkin hal-hal yang sepatutnya kita kritisi adalah bagaimana unsur-unsur tersebut dapat berikatan dan kemudian membentuk senyawa. Sebelum itu, kita harus mengetahui terlebih dahulu apa pengertian dari senyawa kimia. Dan istilah organk seolah-olah berhubungan dengan kata organisme atau jasad hidup.
Organik merupakan zat yang berasal dari makluk hidup (hewan/tumbuhan-tumbuhan) seperti minyak dan batu bara. Pada dasarnya kimia organik melibatkan zat-zat yang diperoleh dari jasad hidup.
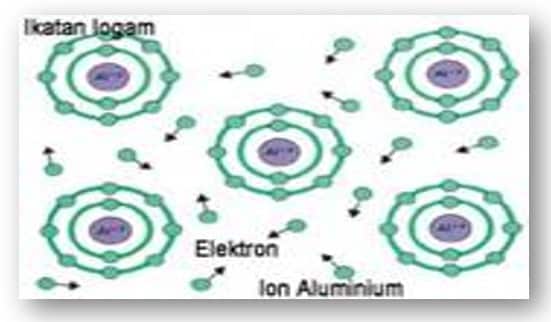
Ikatan Logam.
Ikatan logam adalah ikatan kimia yang terbentuk akibat penggunaan bersama electron elektron valensi antaratomatom logam. Contoh: logam besi, seng, dan perak. Ikatan logam bukanlah ikatan ion atau ikatan kovalen. Salah satu teori yang dikemukakan untuk menjelaskan ikatan logam adalah teori lautan elektron. Contoh terjadinya ikatan logam. Tempat kedudukan elektron valensi dari suatu atom besi (Fe) dapat saling tumpang tindih dengan tempat kedudukan elektron valensi dari atom-atom Fe yang lain.
Tumpang tindih antarelektron valensi ini memungkinkan elektron valensi dari setiap atom Fe bergerak bebas dalam ruang di antara ion-ion Fe+ membentuk lautan elektron. Karena muatannya berlawanan (Fe2+ dan 2 e–), maka terjadi gaya tarik-menarik antara ion-ion Fe+ dan elektron-elektron bebas ini. Akibatnya terbentuk ikatan yang disebut ikatan logam.
Adanya Ikatan Logam menyebabkan Logam bersifat:
- Pada suhu kamar berwujud padat, kecuali Hg.
- Keras tapi lentur atau dapat ditempa.
- Mempunyai titik didih dan titik leleh yang tinggi.
- Penghantar listrik dan panas yang baik.
- Mengkilap.
 |
| (Gambar 5: Contoh Ikatan Logam) |
CONTOH SOAL:
 |
| (Gambar 6: Contoh Soal 1) |
 |
| (Gambar 7: Jawaban Contoh Soal 1) |
| (Gambar 8: Contoh Soal 2) |
| (Gambar 9: Contoh Soal 2) |
KESIMPULAN:
Kesimpulan yang dapat penulis ambil dari pembahasan artikel di atas adalah ikatan kimia saling berkaitan dalam kehidupan sehari-hari. Adapun jenis-jenis ikatan kimia terdiri atas 3 macam, yang pertama adalah ikatan ion yang merupakan ikatan antara unsur-unsur logam dan non-logam, kedua adalah ikatan kovalen yaitu pemakaian elektron secara bersama-sama oleh unsur non-logam dan unsur non-logam, serta ikatan logam yang merupakan pemakaian elektron secara bersama-sama oleh atom-atom logam.
DAFTAR PUSTAKA:
- (Setiawan, Samhis. 2018. Makalah Ikatan Kimia: Pengertian, Jenis Beserta Gambarnya Lengkap. gurupendidikan.co.id Dalam: https://www.gurupendidikan.co.id/makalah-ikatan-kimia-pengertian-jenis-beserta-gambarnya-lengkap/ diakses tanggal 21 November 2018).
- (Surya. 2016. Materi Kimia - Ikatan Kimia. surya.blogchem.com Dalam: http://surya.blogchem.com/materi-kimia-ikatan-kimia/ diakses tanggal 21 November 2018).
- (Anonim. 2016. Contoh Soal & Pembahasan Ikatan Kimia. tanya-tanya.com Dalam: https://tanya-tanya.com/contoh-soal-pembahasan-ikatan-kimia/ diakses tanggal 21 November 2018).
Alhamdulillah
BalasHapus